
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:肠道原虫的细胞外囊泡:宿主-寄生虫交流的隐秘媒介
【字体: 大 中 小 】 时间:2025年08月30日 来源:Gut Pathogens 4
编辑推荐:
这篇综述深入探讨了肠道原虫(如隐孢子虫、贾第鞭毛虫等)分泌的细胞外囊泡(EVs)在宿主-寄生虫互作中的关键作用,揭示了EVs通过携带GP60、CpRom1等蛋白及调控TLR4/IKK、STAT6等通路介导免疫逃逸和炎症反应(如IL-6↑/IL-10↓),为寄生虫病诊断和靶向治疗提供了新视角。
肠道原虫感染是全球健康重大挑战,尤其在卫生条件落后的地区。隐孢子虫(Cryptosporidium spp.)、贾第鞭毛虫(Giardia duodenalis)、溶组织内阿米巴(Entamoeba histolytica)和芽囊原虫(Blastocystis sp.)等通过分泌细胞外囊泡(EVs)与宿主交互,这些纳米级囊泡(30-240 nm)携带蛋白质、RNA和脂质,成为病原体调控宿主免疫和微环境的“分子特洛伊木马”。
EVs的生物发生依赖ESCRT(内体分选复合体)或非ESCRT(如神经酰胺富集)途径。贾第鞭毛虫虽缺乏高尔基体,但其外周囊泡(PVs)通过Rab11蛋白介导EVs释放。EVs通过膜融合、内吞或受体结合三种方式递送 cargo,其脂质双层结构保护内容物(如sRNA)免遭降解,赋予跨生物屏障能力。

ST4和ST7亚型EVs(50-240 nm)通过升高TNF-α/IL-6、抑制IL-10/IL-4(Th2相关)驱动炎症。小鼠模型中,EVs破坏肠上皮完整性,诱发菌群失调(如益生菌减少),与慢性肠炎症状相关。
缺乏经典分泌系统的贾第虫通过MβCD敏感途径释放EVs(60-200 nm),其富含VSPs(变异表面蛋白)和精氨酸脱亚胺酶。EVs可破坏上皮紧密连接,促进非侵袭性大肠杆菌迁移,同时激活Mo-DCs(树突细胞)的NF-κB和SAPK/JNK通路,诱导Th1极化——这解释了贾第虫病后遗症(如吸收不良)的机制。

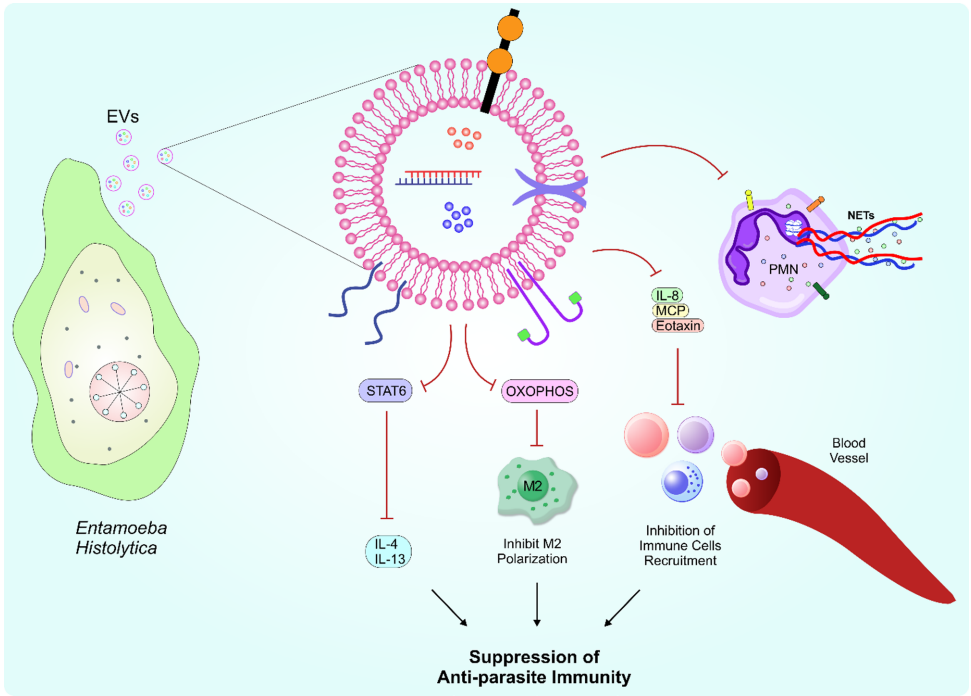
EhEVs通过抑制STAT6磷酸化阻断IL-4/IL-13信号,削弱M2型巨噬细胞极化。其携带的ROS可抑制中性粒细胞NETosis(胞外诱捕网形成),而MPO(髓过氧化物酶)的跨细胞转移进一步帮助寄生虫逃避免疫清除。
宿主上皮细胞在TLR4/IKK激活后分泌富含GP60(糖蛋白60)的EVs,刺激脾细胞炎症反应。CpRom1(膜蛋白)作为EVs标志物,为免疫诊断提供新靶点。
原虫EVs的“双刃剑”特性——既介导免疫逃逸又蕴含稳定生物标志物(如ST4亚型sRNA、GP60蛋白),为开发EVs疫苗(如贾第虫EVs激发Th1应答)和靶向疗法(阻断STAT6/TLR4)开辟新途径。未来需深入解析EVs与菌群互作的“三角关系”,以应对寄生虫耐药和慢性炎症挑战。
 生物通微信公众号
生物通微信公众号
知名企业招聘