
-

生物通官微
陪你抓住生命科技
跳动的脉搏
细菌胞外囊泡通过非裂解机制选择性富集水平转移基因簇的机制解析
【字体: 大 中 小 】 时间:2025年08月30日 来源:The ISME Journal 10.8
编辑推荐:
本研究针对细菌胞外囊泡(BEVs)在水平基因转移(HGT)中的作用机制这一关键科学问题,通过建立单囊泡基因组测序技术(NP-DS),揭示了口腔病原体牙龈卟啉单胞菌(Porphyromonas gingivalis)BEVs中CRISPR-Cas和O-抗原生物合成基因簇的选择性富集现象。研究发现这些基因簇的富集依赖于膜出芽机制而非细胞裂解,并通过比较基因组学证实了BEV介导的基因水平转移在微生物进化中的重要作用,为理解口腔微生物组中基因交流提供了新视角。
在微生物的进化长河中,水平基因转移(HGT)如同一条隐秘的基因高速公路,让细菌们能够快速"共享"抗药性、毒力因子等生存利器。而细菌胞外囊泡(BEVs)作为直径仅100-200纳米的天然包裹,近年被发现可能是这条高速路上的重要"快递员"。然而科学界对BEVs究竟如何选择"打包"哪些基因、这些基因又如何在微生物群体中传播等关键问题仍充满争议。
传统观点认为BEVs中的DNA只是细胞死亡时随机捕获的碎片,但越来越多的证据显示某些功能基因似乎更偏爱搭上这趟"基因快递"。特别是在口腔这个微生物"大都市"里,BEVs可能影响着牙周病原体间的"信息交流"。为了破解这个谜题,来自日本国立材料科学研究所的Sotaro Takano和Akihiro Okamoto*团队在《The ISME Journal》发表重要成果。
研究人员创新性地将微滴式单细胞测序技术改造为单囊泡测序(NP-DS),通过对牙龈卟啉单胞菌和牙菌斑样本中数百个BEVs的DNA分析,结合qPCR验证、透射电镜观察、纳米颗粒追踪等技术,系统研究了BEVs中DNA的组成特征和富集机制。
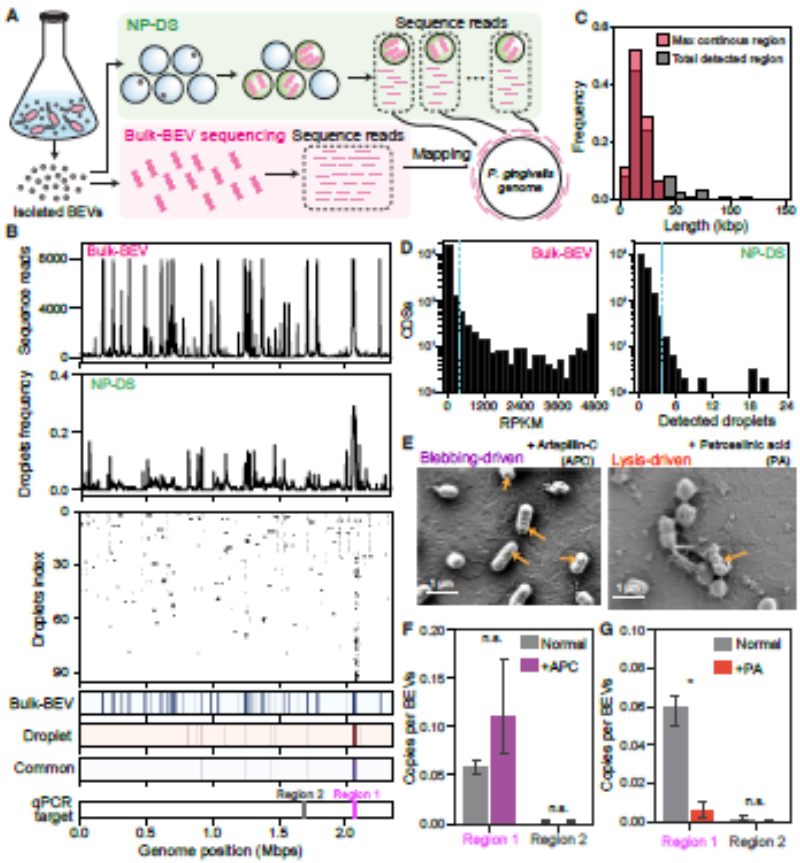
研究首先在"Enrichment of specific genomic regions in P. gingivalis-derived BEVs"部分揭示惊人发现:约60%的牙龈卟啉单胞菌BEVs含有10-30 kbp的DNA片段,且这些片段多源自单一基因组位点。通过膜出芽诱导剂artepillin-C和裂解诱导剂petroselinic acid的对比实验,证实DNA选择性包装依赖于膜出芽机制。
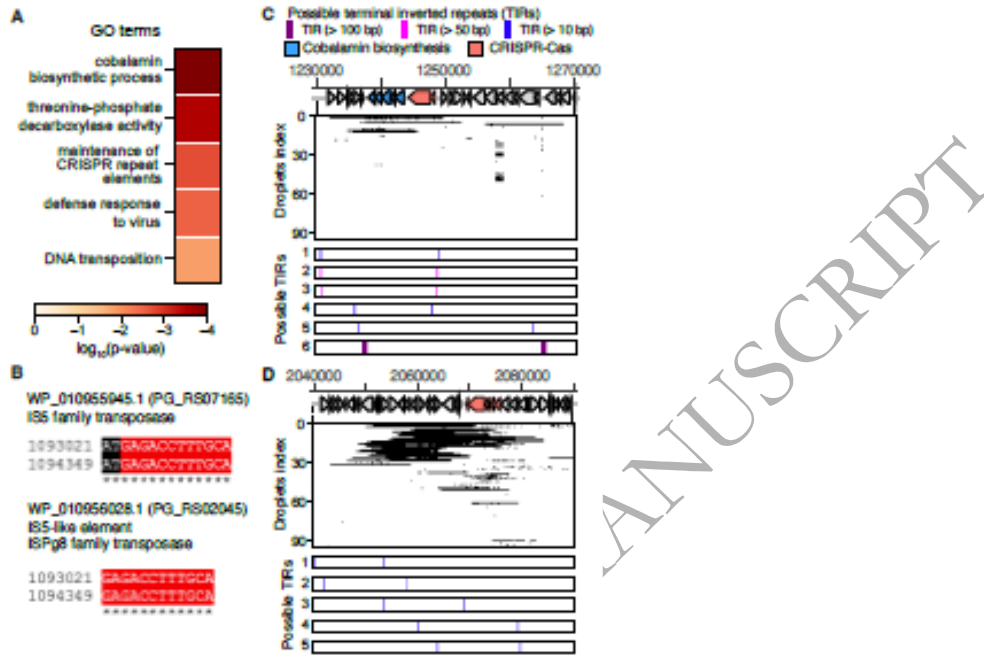
"Functional enrichment of genes in P. gingivalis BEVs"部分显示,BEVs显著富集与基因组重组相关的基因:20%的富集CDSs属于转座酶、位点特异性整合酶和CRISPR-Cas系统。特别值得注意的是,一个完整的VI-B2型CRISPR-Cas基因簇与钴胺素生物合成基因簇相邻,且两侧存在长达600 bp的反向重复序列。
"Prevalence and possible evolutionary history of the gene-cluster"部分通过分析244个Porphyromonas基因组发现,III-B型CRISPR-Cas基因簇呈现"跳跃式"分布特征。比较基因组和系统发育分析显示,该基因簇的进化历史与物种分化存在显著分歧,树形比对推测出4次跨物种水平转移事件。
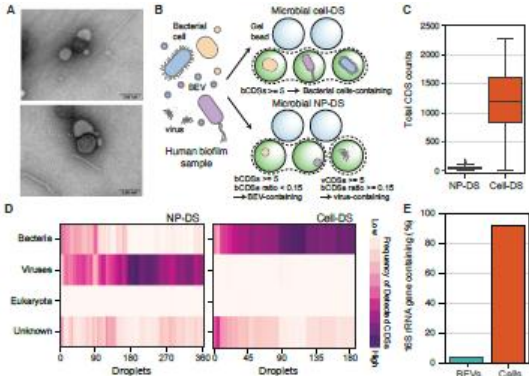
在"Distant characteristics of DNA in BEVs"部分,研究将NP-DS技术应用于牙周炎患者的牙菌斑样本,发现BEVs与细菌细胞的DNA组成大相径庭。令人惊讶的是,牙菌斑中优势菌群(如放线菌)的DNA在BEVs中几乎绝迹,而一些低丰度菌如粪产碱菌(Alcaligenes faecalis)却贡献了大部分BEV-DNA。
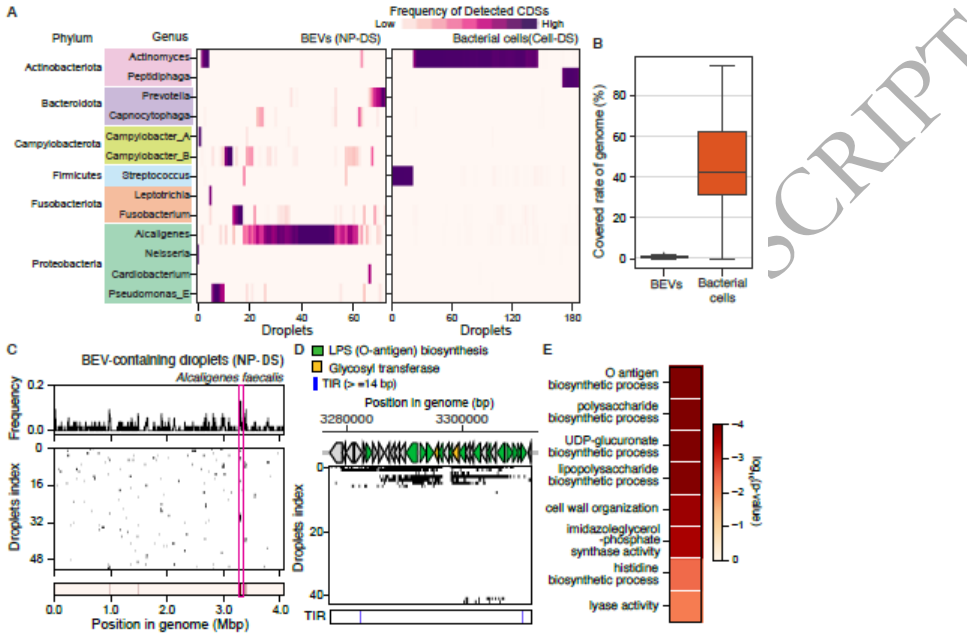
"Enriched DNA sequences in BEV-containing droplets"部分发现,粪产碱菌BEVs中LPS生物合成基因(特别是O-抗原合成基因)显著富集,这些基因与宿主-细菌互作密切相关。生物信息学分析进一步确认这些区域也存在特征性反向重复序列。
这项研究从根本上改变了我们对BEVs在微生物进化中作用的理解:首先证实BEVs能通过非裂解机制选择性包装功能基因簇,且这种选择性与特定的DNA重组特征(如反向重复序列)相关;其次揭示BEVs可能是CRISPR-Cas系统在细菌间传播的重要载体;最后发现口腔微生物组中BEVs的DNA组成与菌群丰度呈反向关系,暗示BEVs可能作为"暗物质"反映微生物组的潜在活动。这些发现为理解微生物适应性进化提供了新视角,也为开发基于BEVs的基因治疗或微生物组调控策略奠定了理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘