
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ProtacID技术:活细胞中PROTAC邻近蛋白鉴定的革命性方法及其在靶向蛋白降解领域的应用
【字体: 大 中 小 】 时间:2025年08月31日 来源:Nature Communications 15.7
编辑推荐:
本研究针对PROTAC(蛋白降解靶向嵌合体)开发中特异性验证的难题,开发了基于BioID(邻近依赖性生物素化)的ProtacID技术。该技术能在活细胞中鉴定PROTAC邻近蛋白,成功区分 productive(可降解)与 non-productive(非降解)相互作用,并应用于染色质、膜蛋白等多类靶点。研究为PROTAC开发提供了关键工具,相关成果发表于《Nature Communications》。
在当今药物研发领域,靶向蛋白降解(Targeted Protein Degradation, TPD)技术因其能靶向传统“不可成药”蛋白而备受瞩目。其中,PROTAC(PROteolysis TArgeting Chimeras)作为双功能分子,通过同时结合靶蛋白和E3泛素连接酶(如VHL或CRBN),诱导靶蛋白泛素化降解。然而,现有技术难以在活细胞中全面鉴定PROTAC的直接作用靶点及非降解性相互作用,这严重制约了PROTAC的精准开发。
为解决这一瓶颈,由Suman Shrestha、Brian Raught等团队在《Nature Communications》发表的研究,开发了名为ProtacID的创新技术。该技术将迷你Turbo生物素连接酶(miniTurbo)与E3连接酶(VHL或CRBNmdi)融合,通过邻近标记策略捕获PROTAC邻近的蛋白质网络。研究首次实现了对PROTAC作用靶点的活细胞验证,并揭示了传统蛋白质组学无法检测的非降解性相互作用,为TPD领域提供了重要方法论突破。
关键技术方法
研究团队通过以下核心实验体系实现目标:
构建稳定表达FLAG-miniTurbo-VHL/CRBNmdi融合蛋白的Flp-In细胞系(包括HEK293、697白血病细胞等6种人源细胞);
联合使用PROTAC处理与neddylation抑制剂MLN4924(阻断靶蛋白降解);
基于链霉亲和素珠的亲和纯化与质谱分析,结合SAINTexpress算法筛选高置信度互作蛋白;
通过Western blot和免疫荧光验证关键发现。
研究结果
ProtacID工具开发
通过测试不同VHL-miniTurbo融合构型(如全长VHL与ΔVHL变体),发现ΔVHL-C端融合miniTurbo的版本效率最高。在BAF复合物靶向PROTAC ACBI1处理中,该工具成功捕获了SMARCA2/4、PBRM1等22个BAF亚基,与标准BioID结果高度一致(图2d)。
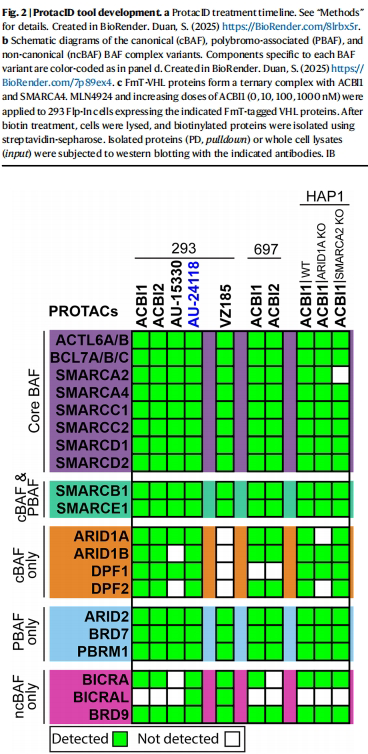
区分BAF复合物亚型
针对靶向不同BAF亚型的PROTAC(如PBAF特异性PROTAC VZI85),ProtacID仅检测到BRD7/9等亚型特异性组分,而cBAF特有蛋白ARID1A/B未被捕获(图3),证明其分辨相近蛋白复合物的能力。
跨细胞系应用验证
在697白血病细胞、HAP1基因敲除细胞等模型中,ProtacID数据与293细胞高度一致。例如,HAP1 SMARCA2敲除细胞中,SMARCA2相关信号完全消失(图3),证实技术的可重复性与遗传背景适应性。
非降解相互作用的发现
全局蛋白质组学未检测到的驱动蛋白KIF20B,被ProtacID鉴定为ACBI1的非降解性结合靶点(图4a)。该发现通过剂量依赖性生物素化实验(图4b)和MLN4924处理对照(图4d)得到验证,揭示了PROTAC可能存在的脱靶效应。
膜蛋白靶点应用
在EGFRL858R突变型非小细胞肺癌细胞(HCC827/NCI-H3255)中,无核定位信号的FmT-ΔVHL成功捕获膜定位EGFR及其互作蛋白(图6b),拓展了技术适用范围。
结论与意义
本研究建立的ProtacID技术突破了PROTAC开发中的三大核心挑战:
直接验证降解靶点,避免传统蛋白质组学的间接推断误差;
首次系统鉴定非降解性相互作用(如KIF20B),为评估PROTAC副作用提供新维度;
无需抗体或基因修饰即可分析内源蛋白复合物,适用于突变体功能研究。
该技术可进一步拓展至MDM2、DCAF16等E3连接酶体系,其“双模式”设计(图4e)既能全面分析PROTAC相互作用组,也能特异性筛选非降解靶点,为TPD药物的临床前评估建立了新标准。
 生物通微信公众号
生物通微信公众号
知名企业招聘