
-

生物通官微
陪你抓住生命科技
跳动的脉搏
LRRK2 G2019S突变通过增强中性粒细胞效应功能加剧感染性结肠炎的肠道炎症
【字体: 大 中 小 】 时间:2025年08月31日 来源:npj Parkinson's Disease 6.7
编辑推荐:
本研究针对帕金森病(PD)与肠道炎症的关联机制,揭示了LRRK2 G2019S突变通过激酶依赖性方式增强中性粒细胞趋化性和NETosis(中性粒细胞胞外诱捕网形成),导致结肠病理损伤加剧和Th17免疫反应偏倚。研究人员采用Citrobacter rodentium感染模型结合单细胞RNA测序和光谱流式技术,发现该突变显著改变中性粒细胞、单核细胞和γδ T细胞的基因表达谱,为PD早期诊断提供了潜在免疫学标志物。该成果发表于《npj Parkinson's Disease》,为理解LRRK2驱动的免疫失调如何参与PD发病提供了新视角。
在神经退行性疾病研究领域,帕金森病(PD)与肠道功能障碍的关联日益受到关注。约50%的PD患者在运动症状出现前数十年就表现出便秘等胃肠道症状,而炎症性肠病(IBD)患者罹患PD的风险也显著升高。这种"肠-脑轴"联系的核心环节之一,是富含亮氨酸重复激酶2(LRRK2)基因的突变——该突变不仅是PD的主要遗传风险因素,也与IBD发病密切相关。特别是LRRK2 Gly2019Ser(G2019S)突变,作为最常见的PD相关突变,能增强激酶活性,但其在肠道免疫微环境中的具体作用机制仍不明确。
为破解这一科学难题,由Jessica Pei和Nathalia L. Oliveira共同领导的研究团队在《npj Parkinson's Disease》发表了突破性成果。研究人员采用基因精确敲入的Lrrk2 G2019S小鼠模型,结合Citrobacter rodentium诱导的感染性结肠炎体系,首次系统揭示了该突变通过重塑中性粒细胞功能而加剧肠道炎症的分子机制。这项研究不仅为理解PD前驱期病理变化提供了新视角,更发现了潜在的早期干预靶点。
关键技术方法包括:1) 建立Lrrk2 G2019S敲入小鼠的Citrobacter rodentium感染模型,通过粪便菌落计数和结肠组织病理学评估感染进程;2) 采用单细胞RNA测序(scRNA-seq)分析感染7天后结肠固有层免疫细胞的转录组特征;3) 光谱流式细胞术验证中性粒细胞等免疫亚群的比例变化;4) 体外迁移实验和中性粒细胞胞外诱捕网(NETosis)检测分析突变中性粒细胞的功能改变;5) 使用特异性激酶抑制剂MLi-2和LRRK2in1验证激酶活性的作用。
研究结果部分呈现了系列重要发现:
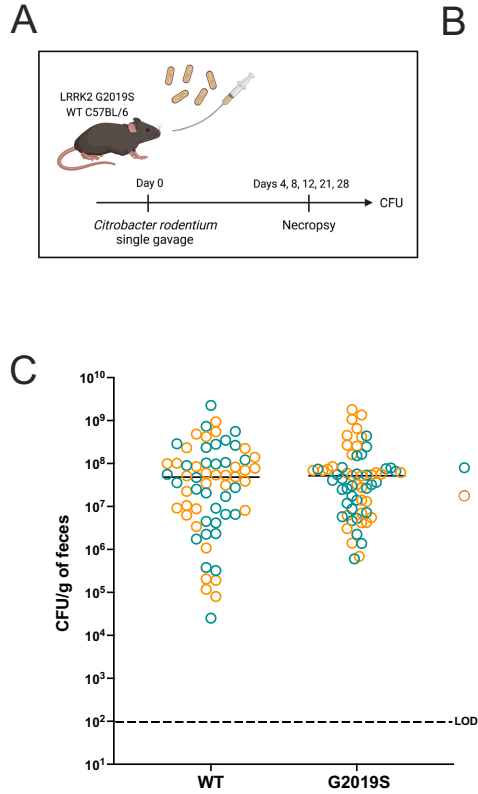
Lrrk2G2019S突变不影响C. rodentium定植或清除
通过监测28天感染周期发现,G2019S与野生型(WT)小鼠的细菌负荷动态变化无显著差异,两组均在21-28天完成病原体清除。这表明突变主要影响宿主免疫反应而非直接抗菌能力。
单细胞RNA测序和流式细胞术显示感染后Lrrk2 G2019S小鼠中性粒细胞增多
scRNA-seq分析13,892个结肠免疫细胞发现,感染组中性粒细胞比例显著增加,且G2019S小鼠增幅更大。流式验证显示G2019S感染组Ly6G+中性粒细胞占比达WT组的2倍,髓过氧化物酶(MPO)活性检测也支持这一发现。值得注意的是,LRRK2表达在B细胞和常规树突状细胞(cDC)中最高。
差异基因表达分析显示G2019S感染小鼠中性粒细胞促炎特征增强
中性粒细胞中22个基因显著上调,包括趋化因子受体CCR1、尿激酶受体PLAUR等迁移相关基因,以及IRF1、STAT1等干扰素信号基因。通路分析显示这些差异基因富集于病毒防御、细胞因子介导的信号传导等炎症相关通路。
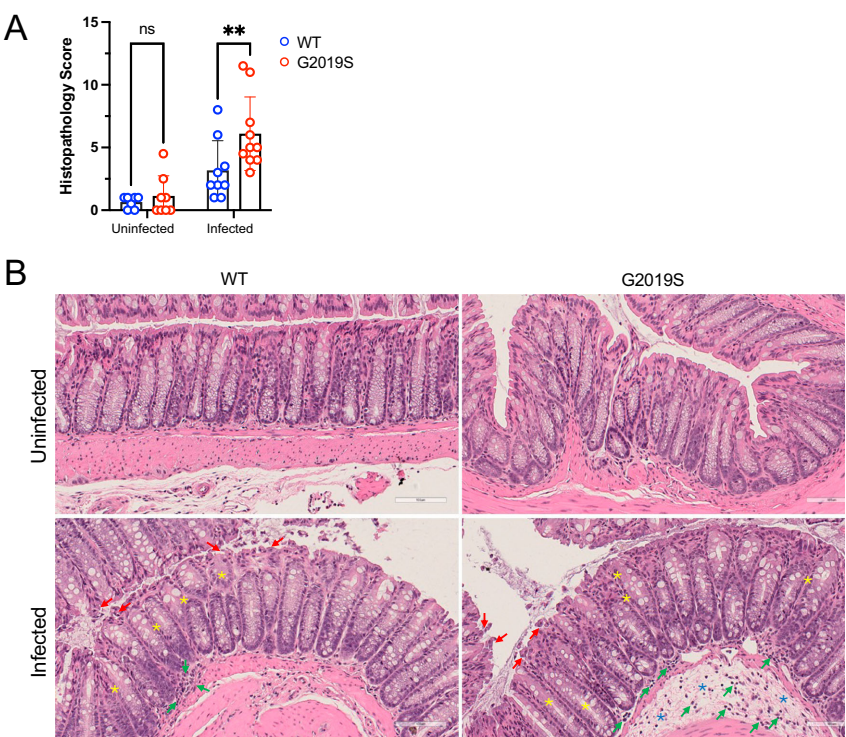
Lrrk2G2019S突变导致感染后结肠组织病理损伤加重
组织学评估显示G2019S感染组出现更严重的炎症浸润、隐窝结构破坏、杯状细胞丢失和水肿,病理评分显著高于WT感染组。这证实突变加剧了感染相关的组织损伤。
G2019S突变引起激酶依赖的中性粒细胞效应功能增强
体外实验显示,G2019S骨髓源性中性粒细胞对C. rodentium的迁移能力提高2倍,NETosis水平增加3倍,这些效应可被激酶抑制剂完全逆转。免疫印迹证实抑制剂能有效降低LRRK2 S935和下游底物Rab10 T73的磷酸化水平。
结肠感染引发Lrrk2 G2019S小鼠Th17细胞偏倚
scRNA-seq发现G2019S感染组Th17细胞比例升高趋势,伴随IL-17A表达上调。流式检测证实RORγt+ Th17细胞增加,qPCR显示结肠IL17a mRNA水平显著升高,提示突变可能通过中性粒细胞-NETosis-Th17轴放大炎症反应。
讨论部分强调,该研究首次在生理相关表达水平(非过表达)的G2019S模型中,揭示其中性粒细胞功能亢进与肠道炎症加重的因果关系。不同于既往聚焦巨噬细胞的研究,本工作发现中性粒细胞是LRRK2调控的关键靶细胞——尽管其LRRK2 mRNA表达较低,但蛋白激酶活性显著,这解释了为何G2019S突变能增强其迁移和NETosis能力。这些发现为临床观察到的PD-IBD共病现象提供了机制解释:LRRK2突变可能通过改变中性粒细胞等免疫细胞功能,创造促炎微环境,最终导致神经退行性变。
研究还提出若干待解问题:G2019S如何精确调控actin细胞骨架重排(如上调的Actg1基因作用);中性粒细胞衍生的NETs是否直接诱导Th17分化;以及重复感染是否会引发PD样运动症状等。这些方向将为后续研究提供路线图。从转化医学角度看,该工作支持LRRK2激酶抑制剂用于PD早期干预的潜力,同时提示循环中性粒细胞功能检测或可作为PD前驱期生物标志物。
这项研究通过多学科方法,将肠道免疫失调与神经退行性疾病巧妙联系,为理解PD发病的"多重打击"假说(遗传易感性+环境触发)提供了重要证据。其发现不仅深化了对LRRK2生物学功能的认识,更为开发针对PD前驱期的精准干预策略奠定了理论基础。
 生物通微信公众号
生物通微信公众号
知名企业招聘