
-

生物通官微
陪你抓住生命科技
跳动的脉搏
吸入式RNA纳米颗粒通过调控肿瘤胶原纤维排列增强肺癌免疫治疗
【字体: 大 中 小 】 时间:2025年08月31日 来源:Nature Communications 15.7
编辑推荐:
研究人员针对肺癌免疫治疗中免疫排斥和免疫抑制性肿瘤微环境(TME)的难题,开发了可同时递送抗DDR1单链抗体片段(mscFv)mRNA和靶向PD-L1 siRNA(siPD-L1)的吸入式脂质纳米颗粒(LNP)系统。该研究通过阻断DDR1-胶原相互作用破坏纤维排列,联合PD-L1沉默逆转免疫抑制,在肺癌原位和转移模型中显著促进T细胞浸润并延长生存期,为实体瘤免疫治疗提供了新策略。
肺癌作为全球癌症相关死亡的主要原因,其治疗面临巨大挑战。尽管免疫检查点阻断(ICB)等免疫疗法取得突破,但实体瘤特有的"铜墙铁壁"——由排列致密的胶原纤维构成的物理屏障,以及免疫抑制性肿瘤微环境(TME),严重阻碍了T细胞浸润和功能发挥。其中,盘状结构域受体1(DDR1)与胶原的结合会促进纤维排列,形成"免疫排斥"状态;同时,程序性死亡配体1(PD-L1)介导的免疫逃逸机制又使浸润的T细胞"瘫痪"。这种双重防御使得肺癌对现有免疫疗法普遍响应率不足20%。
针对这一困境,来自上海交通大学的研究团队Bin Hu、Xue-Qing Zhang等人在《Nature Communications》发表创新研究,巧妙运用吸入式给药技术,将基因治疗与免疫治疗相结合。研究人员设计出能同时携带两种RNA药物的"智能导弹"——脂质纳米颗粒(LNP),通过患者熟悉的吸入方式直达肺癌病灶,实现"一箭双雕"的治疗效果:既瓦解肿瘤的物理防线,又解除其免疫抑制武装。
研究团队首先开发了能耐受雾化的AA3-DLin离子化脂质LNP载体系统。该平台创新性地整合了两种作用机制迥异的RNA药物:编码抗DDR1单链抗体片段(mscFv)的mRNA,以及靶向PD-L1的小干扰RNA(siPD-L1)。通过微流控技术制备的LNP粒径约100nm,经雾化后仍保持结构完整性和基因递送效率。关键实验技术包括:1) 建立原位和转移性肺癌小鼠模型;2) 二次谐波成像(SHG)分析胶原纤维排列;3) 原子力显微镜(AFM)检测组织硬度;4) 流式细胞术评估免疫细胞浸润;5) 体内外基因表达和沉默效率检测。
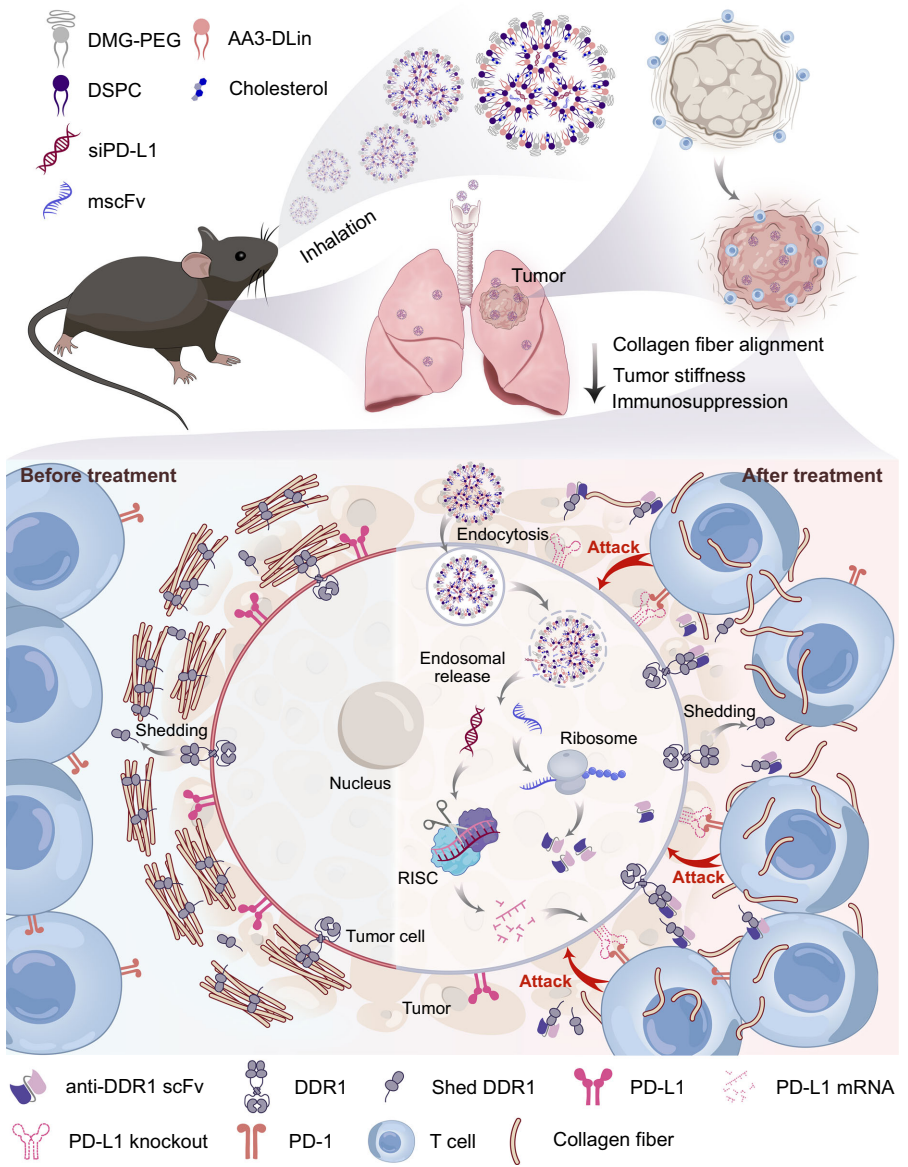
LNP特性与递送效率
雾化后的LNP保持约100nm粒径和-5.5mV zeta电位,在三种肺癌细胞系中实现>80%转染效率。体内实验显示吸入后6小时,90%以上LNP富集于肺部,主要被癌细胞(31.6%)和免疫细胞(41.3%)摄取。抗DDR1 scFv在肺匀浆中48小时达峰(1.2μg/g),可持续表达120小时。
胶原纤维重构机制
SHG成像显示,1mg/kg mscFv@LNP使胶原纤维排列系数降至48.4%,长度缩短40%。AFM检测证实肿瘤硬度降低2.3倍,形成更疏松的TME结构。剂量梯度实验表明,mscFv促进CD8+ T细胞浸润呈剂量依赖性,最高增加7.9倍。
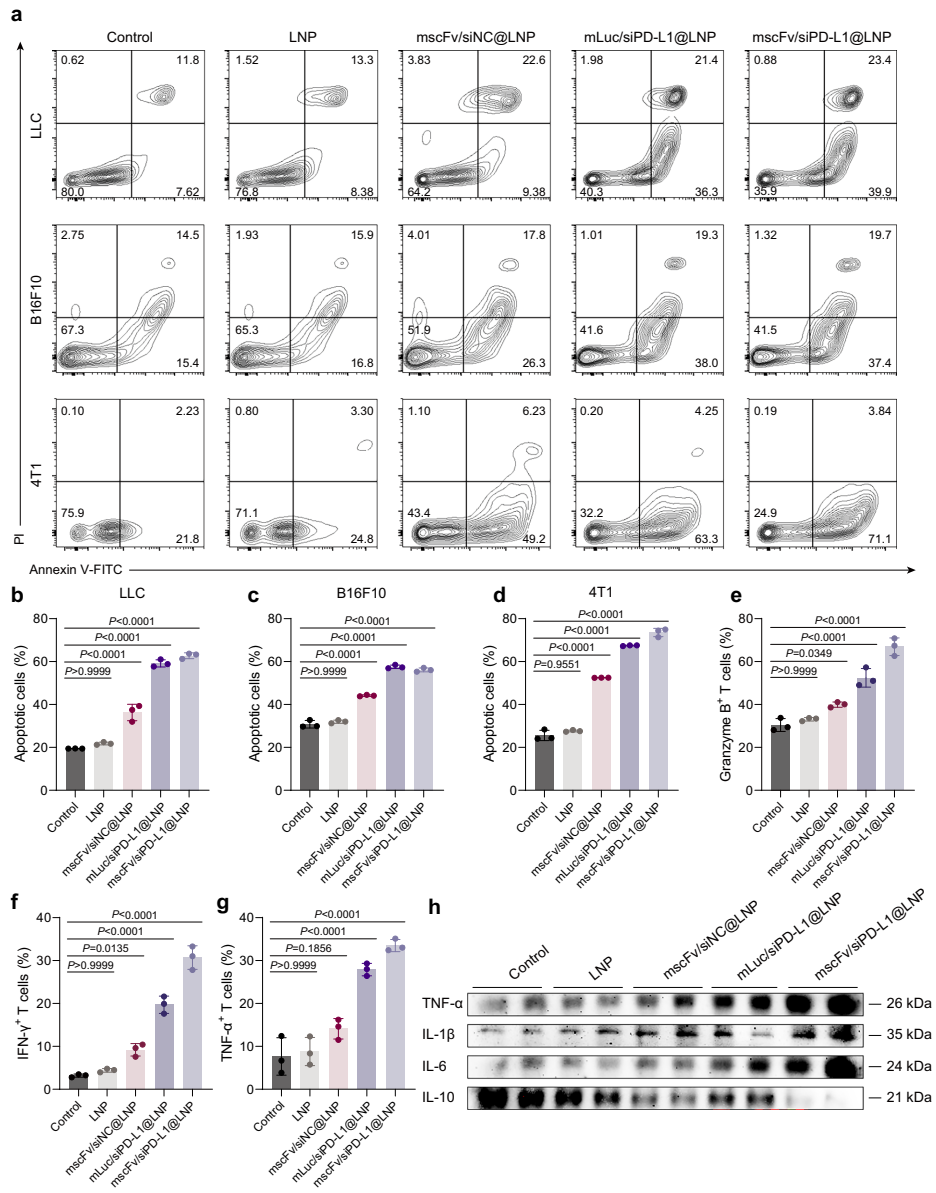
协同抗肿瘤效应
在LLC原位模型中,mscFv/siPD-L1@LNP组小鼠中位生存期延长至54天,50%长期存活。流式分析显示该组CD8+IFN-γ+ T细胞增加4倍,Ki67+增殖T细胞增加3.2倍,Treg和MDSC分别减少62%和58%。细胞因子检测证实治疗组TNF-α和IL-12p70升高2.5倍,免疫抑制性IL-10降低70%。
转移模型验证
在4T1乳腺癌肺转移模型中,联合治疗使转移灶减少76%,肺重量降低58%。免疫分析显示NK和NKT细胞浸润分别增加4.3倍和3.8倍,证实该策略对不同类型肺肿瘤的广谱适用性。
这项研究开创性地将吸入式基因治疗与肿瘤微环境重塑相结合,突破性地解决了实体瘤免疫治疗的两大瓶颈问题。其科学价值主要体现在:1) 首次证实通过吸入递送mRNA抗体可有效调控胶原超微结构;2) 创建"物理屏障解除+免疫检查点阻断"的协同治疗范式;3) 开发具有临床转化潜力的非侵入性给药方案。该策略不仅为肺癌治疗提供新选择,其针对TME的普适性设计思路,还可拓展应用于CAR-T等现有免疫疗法的增效改造。随着LNP递送技术的不断优化,这种"吸入式基因免疫疗法"有望成为对抗实体瘤的新型武器。
 生物通微信公众号
生物通微信公众号
知名企业招聘