
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:HIF-1α:连接脓毒症与急性呼吸窘迫综合征的桥梁
【字体: 大 中 小 】 时间:2025年09月01日 来源:European Journal of Medical Research 3.4
编辑推荐:
这篇综述深入探讨了缺氧诱导因子-1α(HIF-1α)在脓毒症(sepsis)和急性呼吸窘迫综合征(ARDS)中的双重调控作用,揭示了其通过炎症因子(如TNF-α/IL-1β)、代谢重编程(glycolysis)和免疫细胞功能(如M1巨噬细胞极化)影响疾病进展的分子机制,为靶向HIF-1α的临床干预提供了理论依据。
HIF-1α作为缺氧诱导因子家族的核心成员,由氧敏感的α亚基和组成型表达的β亚基(ARNT)构成,其稳定性受氧依赖(PHDs/VHL通路)和非氧依赖(NF-κB/STAT3通路)双重调控。在缺氧或炎症刺激下,HIF-1α通过bHLH-PAS结构域与HIF-1β结合形成异源二聚体,激活下游靶基因(如VEGF、HO-1)的转录,参与血管生成、炎症反应和能量代谢等过程。
脓毒症引发的全身炎症反应可导致肺泡上皮损伤、毛细血管渗漏和中性粒细胞浸润,进而诱发ARDS。研究显示,脓毒症患者血浆HIF-1α水平显著升高,其通过以下途径加剧肺损伤:
内皮功能失调:HIF-1α上调血管内皮生长因子(VEGF)表达,破坏紧密连接蛋白(如claudin-5),增加血管通透性;
免疫细胞异常活化:促进M1巨噬细胞极化(通过IL-1β持续分泌)和中性粒细胞存活(抑制凋亡),加剧炎症风暴;
线粒体功能障碍:通过调控HO-1和糖酵解酶(如HK2)维持细胞能量稳态,但过度激活可能导致氧化应激。
促炎作用:
通过NF-κB通路增强TNF-α/IL-6表达,放大炎症级联反应;
促进Th17细胞分化(依赖RORγt),打破免疫平衡。
保护作用:
上调HO-1减轻氧化应激;
通过FoxM1信号促进肺泡Ⅱ型上皮细胞增殖,加速损伤修复。
药物调控HIF-1α呈现双向潜力:
抑制剂(如Tanshinone IIA):通过阻断PKM2/HIF-1α轴抑制M1巨噬细胞极化;
激活剂(如DMOG):稳定HIF-1α以增强线粒体自噬,改善微循环障碍。
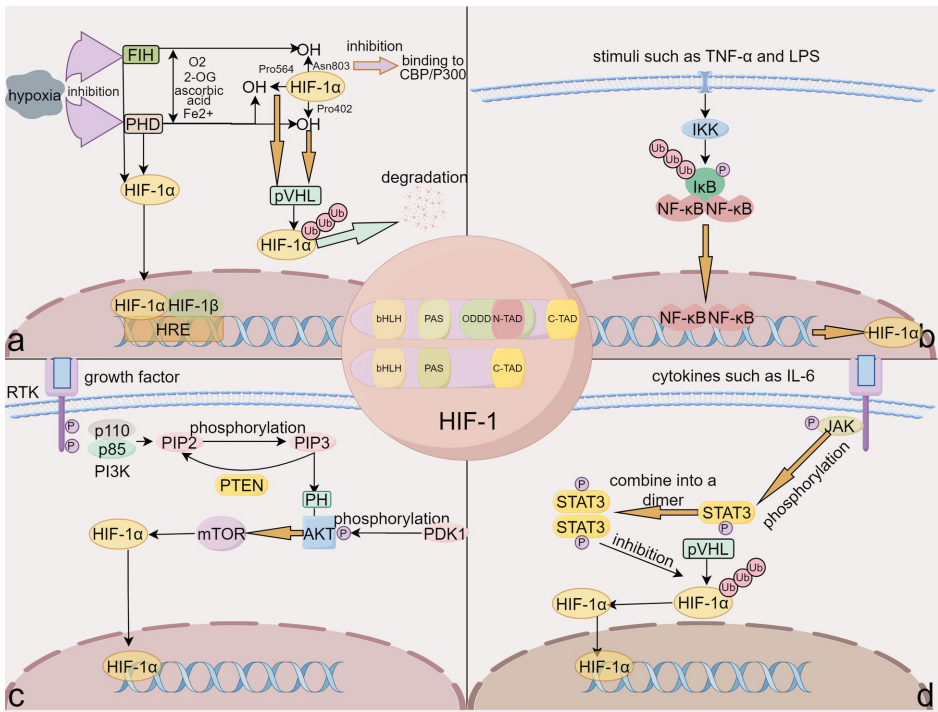
需进一步阐明HIF-1α在特定细胞类型(如肺泡巨噬细胞)中的时空特异性作用,并开发精准调控策略以平衡其促炎与保护效应。
 生物通微信公众号
生物通微信公众号
知名企业招聘