
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:黄芪甲苷-IV在肝细胞癌治疗中的分子机制:系统综述
【字体: 大 中 小 】 时间:2025年09月02日 来源:BMC Cancer 3.4
编辑推荐:
这篇系统综述全面总结了黄芪甲苷-IV(AS-IV)在肝细胞癌(HCC)治疗中的多靶点作用机制,包括抑制肿瘤增殖/转移、诱导凋亡、调节免疫(PD-L1)、逆转耐药(MDR1)及抗血管生成(VEGF)等通路,为天然药物开发提供了重要理论依据。
肝细胞癌(HCC)作为全球第六大常见恶性肿瘤,其高复发率和转移特性导致临床治疗面临严峻挑战。传统中药黄芪的主要活性成分黄芪甲苷-IV(AS-IV)因其多靶点作用特点,在抗肿瘤领域展现出独特优势。现有研究表明,AS-IV可通过调控多条信号通路抑制HCC进展,但其具体分子机制尚未系统阐明。
AS-IV通过Nrf2介导的TGF-β/Smad3通路显著抑制HCC细胞增殖,这种抑制作用呈现明显的剂量和时间依赖性。在SK-Hep1和Hep3B细胞系中,100-200μM浓度的AS-IV处理1-2天即可诱导G1期阻滞,同时下调cyclin D1和CDK4等细胞周期调控蛋白。值得注意的是,AS-IV还能通过调控KAT2A介导的PGAM1琥珀酰化修饰,抑制HCC细胞的糖酵解过程。
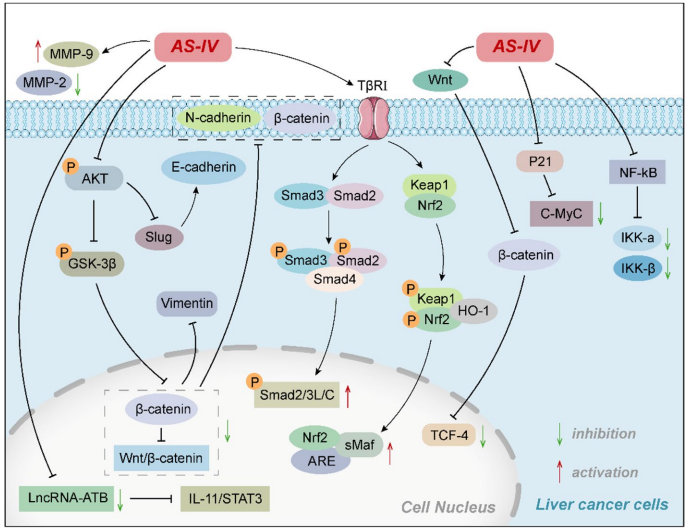
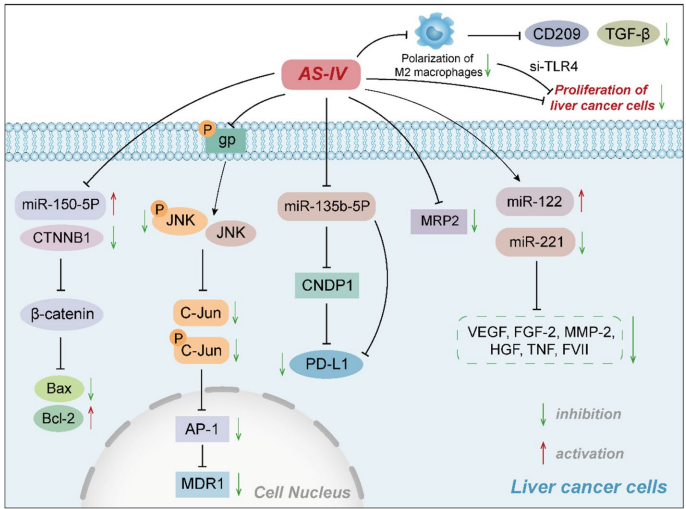
AS-IV通过双重途径激活HCC细胞凋亡程序:一方面通过上调miR-150-5p抑制β-catenin信号,另一方面通过线粒体途径增加Bax/Bcl-2比例,促进caspase-9和caspase-3的活化。在HepG2细胞中,25-100μM AS-IV处理48小时可使凋亡率提升2-3倍,同时显著降低抗凋亡蛋白survivin的表达水平。
上皮-间质转化(EMT)是HCC转移的关键环节。AS-IV通过Akt/GSK-3β/β-catenin通路下调N-cadherin和vimentin等EMT标志物,在Huh-7细胞模型中,64μM剂量即可使细胞迁移能力降低60%以上。此外,AS-IV还能特异性抑制长链非编码RNA ATB的表达,阻断IL-11/STAT3信号通路的活化。
AS-IV通过miR-135b-5p/CNDP1轴降低HCC细胞表面PD-L1表达,改善肿瘤微环境免疫抑制状态。动物实验显示,150mg/kg剂量的AS-IV可使肿瘤组织中CD8+ T细胞浸润增加40%,同时显著抑制M2型巨噬细胞的极化过程。
针对5-氟尿嘧啶耐药的Bel-7402/FU细胞系,AS-IV通过抑制JNK/c-Jun/AP-1信号通路,使MDR1表达降低50-70%。在顺铂耐药模型中,AS-IV还能下调MRP2转运蛋白表达,使化疗药物细胞内浓度提升2.5倍。
现有研究主要集中于细胞和动物实验层面,临床转化证据仍显不足。不同研究采用的AS-IV剂量差异较大(体外4-200μM,体内20-150mg/kg),需要进一步优化给药方案。未来研究应重点关注AS-IV与其他靶向药物的协同作用,并通过类器官模型等新技术加速临床转化进程。
作为天然来源的多靶点抗肿瘤候选药物,AS-IV通过调控增殖凋亡平衡、EMT过程、免疫微环境重塑等多重机制抑制HCC进展。其低毒性和高耐受性特点为开发新型HCC联合治疗方案提供了重要选择,但需更多高质量临床研究验证其实际应用价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘