
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Lewis大鼠肝脏不同区域性别特异性基因表达模式的发现及其对肝移植预后的启示
【字体: 大 中 小 】 时间:2025年09月02日 来源:Scientific Reports 3.9
编辑推荐:
本研究针对肝移植中性别差异影响预后的临床问题,通过全基因组测序揭示了Lewis大鼠肝脏存在543个性别差异表达基因(如Cyp2c111433倍上调),首次发现肝脏不同叶段(右外侧叶/中叶/左外侧叶)存在显著的空间异质性(雄性差异基因达40个)。研究证实胆固醇稳态和雌激素反应通路(NES=-2.06)的性别差异可能解释女性供肝男性受者(female-to-male)移植预后较差的现象,为优化器官分配策略提供分子依据。
肝脏作为人体最大的代谢器官,其功能存在显著的性别二态性。临床数据显示,当女性肝脏移植给男性患者时(female-to-male),移植肝的存活率明显低于其他性别组合。这一现象长期被归因于器官尺寸不匹配,但最新证据表明,年轻女性供体的肝脏即使尺寸合适,仍会导致男性受者预后不良——暗示着更深层次的生物学机制可能参与其中。
为揭示这一谜题,由Luisa Sophie Rajcsanyi领衔的国际团队在《Scientific Reports》发表重要研究。团队选择Lewis大鼠(Lew/NHanZtm)作为模型,因其肝脏性别差异与人类具有可比性。研究人员创新性地将每只大鼠肝脏分为右外侧叶、中叶和左外侧叶三个解剖区域,通过高通量RNA测序(RNA-seq)结合生物信息学分析,绘制了迄今最全面的肝脏性别差异基因表达图谱。
关键技术方法
研究选取4雄4雌12周龄Lewis大鼠,解剖获取肝脏三叶样本(24个样本)。采用QuantSeq 3'mRNA-Seq建库,Illumina NextSeq2000测序。数据分析使用HISAT2比对至rn6基因组,DESeq2进行差异表达分析(padj<0.05,|log2FC|>1),fgsea进行通路富集。实验通过LAVES伦理审查(2018/623)。
主要研究结果
全肝性别差异表达谱
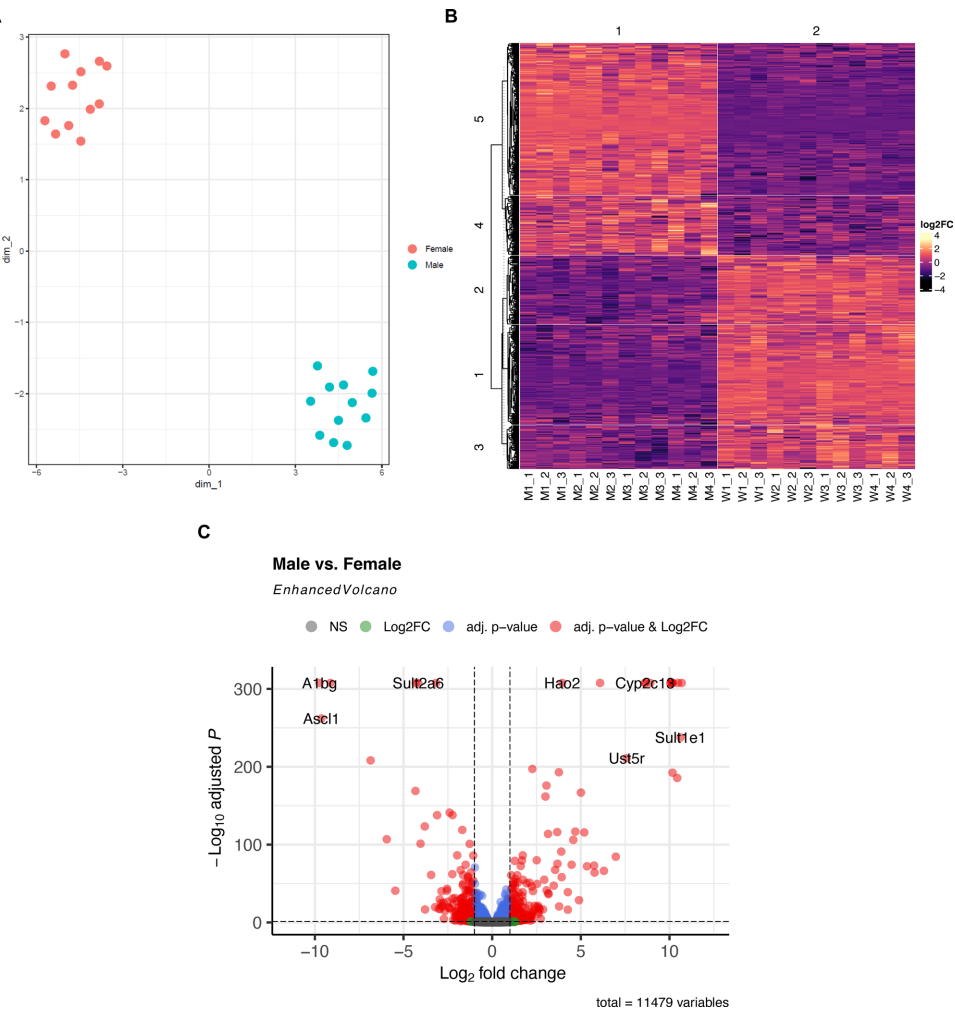
雄性肝脏中Cyp2c13表达量达雌性394倍(log2FC=8.62),而雌性标志物A1bg在雄性中降低849倍(log2FC=-9.73)。GSEA分析显示,雄性下调基因显著富集于胆固醇稳态(NES=-2.06)和晚期雌激素反应通路(NES=-2.01),提示性激素调控的代谢差异可能是移植预后的关键。
肝叶特异性表达模式
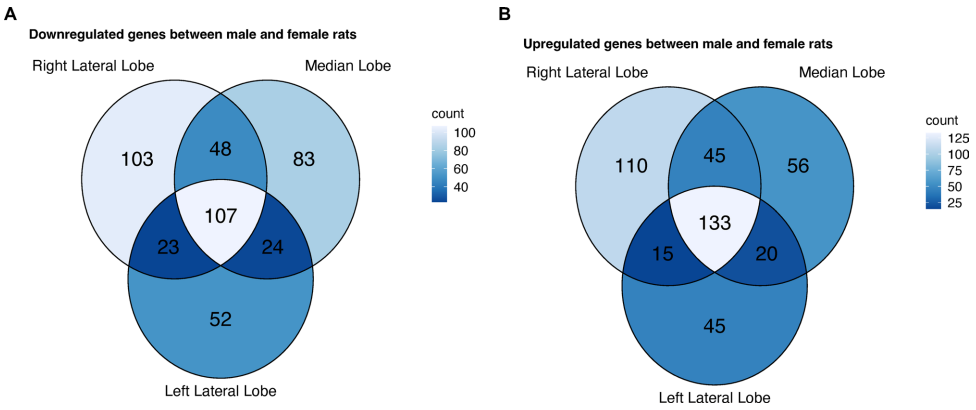
研究发现240个基因在所有肝叶均显示性别差异,但各叶另有独特模式:右外侧叶雄性特异性下调基因ENSRNOG00000037911.2(log2FC=-8.03),而左外侧叶特有上调基因ENSRNOG00000046024.2表达量达雌性2062倍。这种空间异质性提示单一肝叶采样可能导致数据偏差。
肝内区域异质性
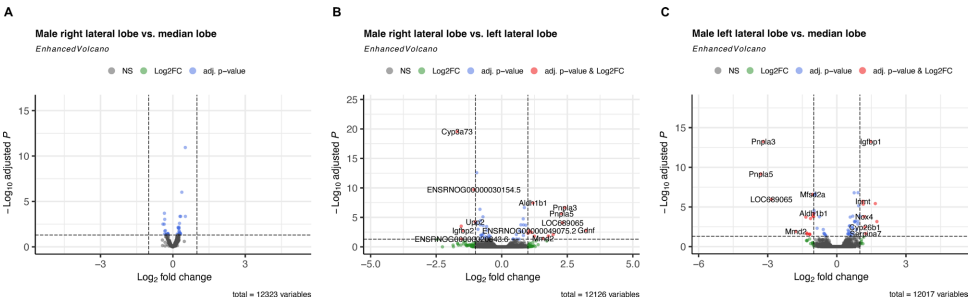
特别值得注意的是,雄性肝脏内部差异更显著:中叶vs左外侧叶有22个差异基因,而雌性相同比较仅2个基因差异。这种雄性特有的肝内异质性可能与激素受体分布有关。
讨论与意义
该研究首次系统揭示:1)Lewis大鼠肝脏存在胆固醇代谢(HMG-CoAR等)和雌激素信号通路的性别差异;2)肝移植预后差的female-to-male组合可能与受体雄激素和供肝雌激素受体(ERα/β)的互作失衡有关;3)肝脏空间异质性要求未来研究规范采样部位。
这些发现为肝移植器官分配算法优化提供了分子依据:年轻女性供肝可能因高雌激素响应基因(如Akr1b7)和低胆固醇代谢能力,难以适应男性受体的高代谢需求。团队建议后续研究应检测移植后性别差异基因(如Cyp2c12)的动态变化,并开发针对雌激素受体通路的干预策略。
这项研究突破了传统"尺寸决定论"的认知局限,将肝脏移植预后研究推向分子水平。其采用的跨叶段采样策略和全基因组分析方法,也为其他器官移植研究提供了范式参考。未来或可基于这些基因标记,建立供受体性别匹配的精准评估体系。
 生物通微信公众号
生物通微信公众号
知名企业招聘