
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:基于肠促胰岛素激动剂的抗肥胖药物对脂肪组织的作用机制
【字体: 大 中 小 】 时间:2025年09月03日 来源:Current Obesity Reports 11
编辑推荐:
这篇综述系统阐述了GLP-1R(胰高血糖素样肽-1受体)、GIPR(葡萄糖依赖性促胰岛素多肽受体)和GCGR(胰高血糖素受体)激动剂通过中枢和外周机制调控脂肪组织代谢的突破性进展。文章揭示了这些药物不仅能减少内脏脂肪(VAT),还能促进白色脂肪组织(WAT)褐变和棕色脂肪组织(BAT)活化,为肥胖及相关代谢疾病治疗提供了新靶点。特别强调了多受体激动剂(如tirzepatide)通过钙循环等创新机制增强能量消耗的转化医学价值。
脂肪组织在肠促胰岛素类抗肥胖药物中的作用机制
肥胖已成为全球健康危机,传统生活方式干预效果有限,而基于肠促胰岛素的药物如GLP-1R激动剂(如semaglutide)和双受体激动剂tirzepatide展现出突破性疗效。这些药物通过复杂机制调控脂肪组织生物学特性,不仅减少脂肪量,更能改善脂肪功能。
GLP-1R激动剂与白色脂肪组织
GLP-1R激动剂通过中枢神经系统(CNS)的GLP-1受体抑制食欲,显著降低脂肪量(semaglutide治疗68周减少20%总脂肪)。特别值得注意的是,这类药物能选择性减少有害的内脏脂肪(VAT),同时相对保留皮下脂肪。临床数据显示liraglutide可使内脏脂肪减少更显著,并改变脂肪分布模式,增加下肢皮下脂肪比例。

尽管脂肪细胞GLP-1R表达存在争议,但研究发现GLP-1R激动剂能改善脂肪组织代谢活性,上调脂联素、降低瘦素水平。特别在特殊脂肪库如心外膜脂肪(与心血管风险相关)和肾周脂肪(与高血压相关)中,liraglutide显示出显著减少效果。这些变化可能通过减轻脂肪组织炎症(如减少巨噬细胞浸润)和改善脂肪因子分泌谱实现。
GIPR激动剂与脂肪组织代谢革命
双受体激动剂tirzepatide的卓越疗效(体重减轻24-28%)部分归功于GIPR组分对脂肪组织的直接作用。不同于传统认知,最新研究证实GIPR在脂肪细胞有功能性表达,并通过"代谢开关"机制调控营养代谢:
• 餐后状态(高胰岛素):增强脂蛋白脂肪酶(LPL)活性,促进甘油三酯清除
• 空腹状态(低胰岛素):激活脂肪分解

突破性发现是GIPR能激活白色脂肪细胞内质网钙泵(SERCA)驱动的无效钙循环,通过ATP水解增加能量消耗。这种UCP1非依赖的产热机制为肥胖治疗提供了新思路。
胰高血糖素受体激动剂的产热潜能
GLP-1R/GCGR双激动剂(如cotadutide)和三激动剂(如retatrutide)通过GCGR组分显著增强能量消耗。机制包括:
直接激活BAT中GCGR-cAMP通路
诱导肝脏分泌FGF21(成纤维细胞生长因子21)和胆汁酸
促进WAT褐变(beige脂肪形成)
值得注意的是,GCG在UCP1敲除小鼠中仍能增加能耗,提示存在新型产热通路。临床试验显示这类药物能减轻体重同时保持基础代谢率。
脂肪组织产热可塑性的调控网络
肠促胰岛素类药物通过多维度机制激活脂肪组织产热:
中枢-交感神经通路
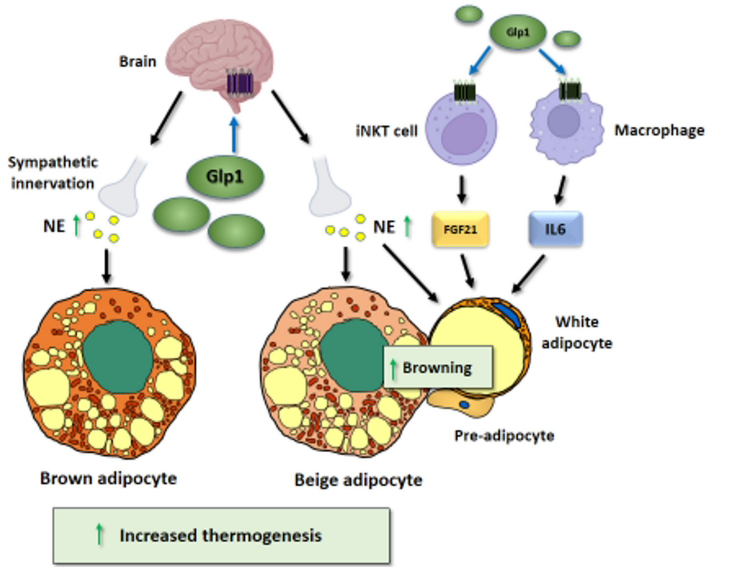
GLP-1R激动剂通过下丘脑室旁核激活交感神经系统,增加BAT活力和WAT褐变。动物实验证实中枢给予exendin-4可增加交感神经输出。
免疫-脂肪细胞对话
• GLP-1激活iNKT细胞促进FGF21分泌
• 单核细胞IL-6通过受体信号促进棕色脂肪生成
• GIP调节髓系细胞减轻炎症,促进2型免疫反应
多受体协同效应
tirzepatide通过GIPR组分:
• 降低支链氨基酸(BCAA)水平
• 改善BAT葡萄糖摄取
• 诱导产热相关基因表达
临床转化与未来展望
现有证据表明脂肪组织重塑是肠促胰岛素类药物疗效的关键介质。未来研究需关注:
• 不同脂肪库(如血管周围脂肪)的特异性反应
• 性别差异对治疗效果的影响
• 药物对"肥胖记忆"的表观遗传调控
• 肌肉-脂肪组织crosstalk对瘦体重保护的作用
多受体激动剂的快速发展正推动肥胖治疗进入精准时代,通过靶向脂肪组织代谢可塑性实现代谢健康的重编程。
 生物通微信公众号
生物通微信公众号
知名企业招聘