
-

生物通官微
陪你抓住生命科技
跳动的脉搏
淡水螺肠道菌群中Lysinibacillus macroides、Kurthia huakuii和Enterococcus faecium的益生、抗菌及抗癌特性研究
【字体: 大 中 小 】 时间:2025年09月04日 来源:BMC Biotechnology 3.4
编辑推荐:
本研究从非寄生虫传播的淡水螺(Lanistes carinatus、Cleopatra bulimoides和Helisoma duryi)肠道菌群中分离出Lysinibacillus macroides、Kurthia huakuii和Enterococcus faecium,证实其具有耐酸耐胆盐特性(存活率>97%)、广谱抗菌活性(抑菌圈23-32mm)及显著抗癌效果(K.huakuii对Caco-2细胞的IC50为30%)。通过16S rRNA测序和MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴盐)实验揭示,这些菌株代谢产物可诱导肿瘤细胞凋亡(caspase-3表达提升30.2%),为开发新型抗癌益生菌提供资源。
在抗生素耐药性加剧和环境污染物增多的全球背景下,寻找新型微生物资源成为迫切需求。传统微生物来源如土壤和哺乳动物肠道已被广泛研究,而淡水螺这类软体动物的肠道菌群仍是一片待开发的"微生物宝库"。更引人注目的是,某些海洋软体动物已被发现能产生强效抗癌肽,这暗示着软体动物来源的生物活性物质具有巨大医疗潜力。然而,作为寄生虫非传播宿主的淡水螺,其肠道菌群组成与功能研究仍存在显著空白。
这项发表在《BMC Biotechnology》的研究首次系统分析了三种非洲淡水螺(L.carinatus、C.bulimoides和H.duryi)的肠道菌群特征,并从中筛选出具有多重生物活性的益生菌株。研究人员采用Illumina MiSeq平台进行16S rRNA基因测序分析螺类肠道菌群结构,通过体外实验评估菌株的耐酸耐胆盐能力,采用MTT法检测代谢产物对结肠癌细胞(Caco-2)的细胞毒性,并运用免疫组化技术分析凋亡标志物caspase-3和炎症因子TNF-α的表达变化。
微生物群落分析显示:
通过新一代测序技术鉴定出32个细菌门,在所有螺种中均以Pseudomonadota(44-70%)和Bacteroidota(17-20%)为优势菌门。值得注意的是,H.duryi展现出最高的微生物多样性,含有Vernucomicrobiota(10%)和Myxococcota(20%)等特殊菌群,而L.carinatus则富含Bacillota(15%)。LEfSe分析发现12个具有生物技术潜力的菌种,包括产抗菌物质的Janthinobacterium lividum和具有生物修复功能的Desulfovibrio putealis。
益生特性验证:
从三种螺肠道中成功分离的L.macroides、K.huakuii和E.faecium均表现出γ-溶血特性(安全指标)和DNase阴性。它们能耐受pH2.5的强酸环境(6小时存活率>97%)和0.7%胆盐浓度,其中E.faecium对全部测试抗生素敏感,而K.huakuii对庆大霉素和四环素耐药。所有菌株均显示出广谱抗菌活性,对金黄色葡萄球菌(Staphylococcus aureus)和铜绿假单胞菌(Pseudomonas aeruginosa)等病原体的抑菌圈达26-32mm。
抗癌机制研究:
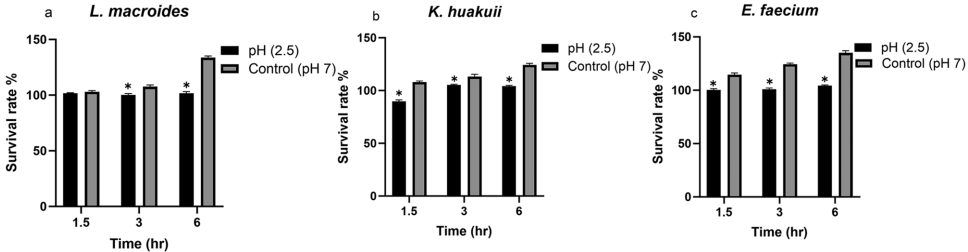
MTT实验揭示K.huakuii代谢产物对Caco-2细胞具有最强细胞毒性(IC50=30%),显著高于L.macroides和E.faecium(IC50=90%)。H&E染色显示经K.huakuii处理的癌细胞出现明显凋亡特征:细胞皱缩、染色质凝集和膜起泡。免疫组化证实其能显著提升caspase-3表达(凋亡指数30.2±1.51),同时轻度抑制促癌因子TNF-α的表达,表明其具有"双效"作用——既诱导肿瘤细胞凋亡又减轻炎症微环境。

该研究首次系统揭示了非寄生虫传播淡水螺肠道菌群的生态特征和生物技术价值,从中发掘的K.huakuii等菌株展现出独特的"益生-抗癌"双重功能。这些发现为开发新型微生物抗癌制剂提供了候选菌种,其耐消化道环境特性(存活率>97%)和自动聚集能力(24小时达90%)更预示其在实际应用中的稳定性。特别值得注意的是,螺源菌株的代谢产物通过激活caspase-3通路特异性诱导肿瘤细胞凋亡,避免了传统化疗药物的毒副作用,为癌症的微生物疗法开辟了新思路。未来研究可进一步解析其活性成分并开展动物实验,推动这类"生态友好型"抗癌益生菌的临床应用。
 生物通微信公众号
生物通微信公众号
知名企业招聘