
-

生物通官微
陪你抓住生命科技
跳动的脉搏
枯草芽孢杆菌核糖体相关内切核酸酶Rae1通过切割停滞核糖体上游mRNA调控基因表达的新机制
【字体: 大 中 小 】 时间:2025年09月04日 来源:Nucleic Acids Research 13.1
编辑推荐:
本研究揭示了枯草芽孢杆菌(Bacillus subtilis)中核糖体相关内切核酸酶Rae1通过识别停滞核糖体上游12核苷酸位点切割mRNA的分子机制。研究人员发现Rae1对fliY mRNA的切割依赖延伸因子P(EF-P)缺失导致的SPP基序核糖体停滞,并通过toeprint实验证实spyA mRNA终止密码子处的核糖体停滞现象。研究阐明了终止密码子与切割位点距离(12 nt)的关键作用,以及SpyA/BmrX肽链序列对Rae1切割的特异性调控。该发现为理解细菌翻译质量控制提供了新视角,发表于《Nucleic Acids Research》。
在细菌的基因表达调控中,mRNA的稳定性与翻译过程紧密偶联,形成精细的质量控制网络。然而,关于核糖体停滞如何触发特定mRNA降解的分子机制仍存在诸多未知。枯草芽孢杆菌(Bacillus subtilis)作为革兰氏阳性模式菌,其RNA降解机制与大肠杆菌等革兰氏阴性菌显著不同,尤其缺乏对核糖体相关核酸酶调控机制的认识。这项研究聚焦于核糖体相关内切核酸酶Rae1——一个在厚壁菌门、蓝细菌和高等植物叶绿体中保守存在但功能未知的酶类,旨在揭示其如何通过感知翻译停滞状态来调控mRNA命运。
研究人员采用Northern blot、引物延伸和toeprinting等关键技术,结合体内外翻译-切割实验系统。使用枯草芽孢杆菌W168及其突变株(包括△rae1、△efp等)作为研究对象,通过整合pHM2质粒构建系列报告基因。体外实验采用纯化的B.subtilis 70S核糖体、Rae1及释放因子RF1/RF2,配合35S标记的体外翻译体系。
Rae1在fliY mRNA上的切割依赖SPP停滞基序
通过构建fliY△截短体,发现EF-P缺失时Rae1在距第二个脯氨酸密码子12 nt上游切割mRNA(图1)。突变SPP基序(P165A P166A)使切割效率降低2.2倍,证实核糖体停滞是切割前提。
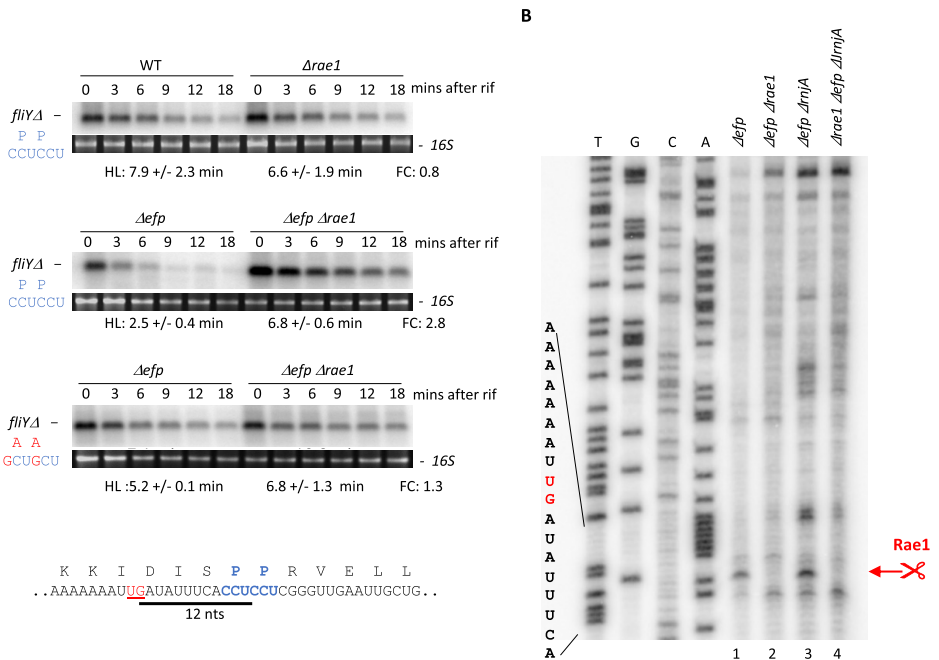
终止密码子处的核糖体停滞驱动切割
Toeprint实验显示spyA mRNA的UAG终止密码子处存在核糖体停滞(图2橙色箭头),而+1移码突变体无此现象。关键发现是:当终止密码子与Rae1位点距离从12 nt增至30 nt(spyA+18nts),切割完全消失;而重新引入12 nt间距(spyA UAG+18nts)可恢复敏感性(图3)。
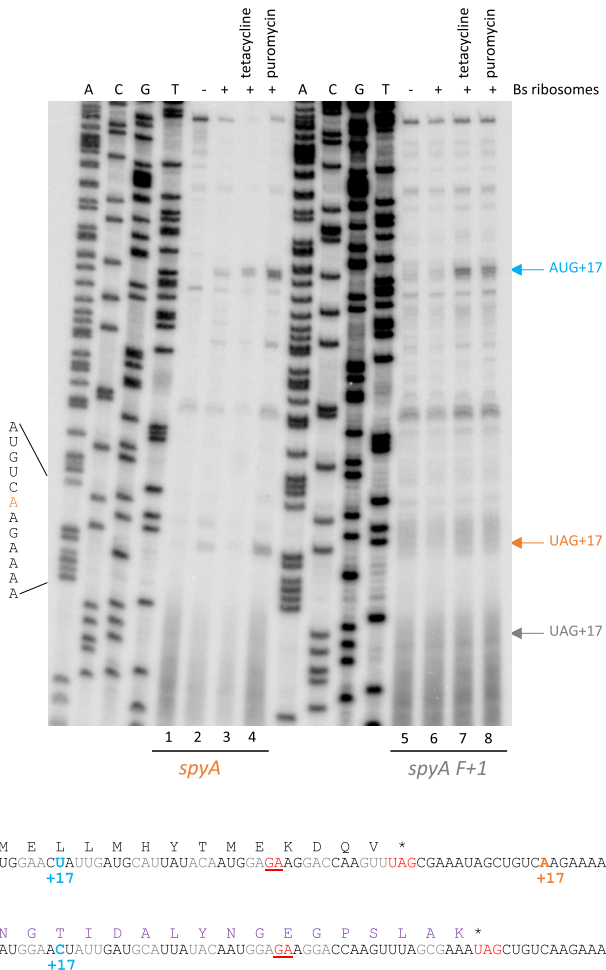
释放因子调控切割效率
RF1对UAG终止密码子的低效识别促进停滞:spyA(UAG)的Rae1敏感性(5.9倍)高于spyA(UGA)(2.1倍)。体外实验显示过量RF2可抑制UGA转录本的切割(0.2倍),而RF1对UAG转录本无影响(图6),表明终止效率与切割负相关。
肽链序列的关键作用
spyA-AAmod(14/17氨基酸突变)虽保持12 nt间距却丧失切割活性(图7)。N端删除实验显示:保留最后13个氨基酸(5ELLMHYTMEKDQV17)的gfp融合体仍具Rae1敏感性,而更短的片段则失效(图9)。E5A突变显著降低切割效率,提示该位点空间位阻对停滞的贡献。
该研究首次阐明Rae1通过"测量"终止密码子距离(12 nt)和解读特定肽链序列来识别停滞核糖体的双重机制。这一发现不仅解释了spyTA毒素-抗毒素系统和bmrBXCD多药外排泵的转录后调控原理,更揭示了细菌中新型翻译质量控制通路——不同于大肠杆菌SmrB或酵母Cue2,Rae1代表了一类通过切割停滞核糖体尾部(而非A位点)来耦合翻译与mRNA降解的独特机制。鉴于Rae1在多种病原菌中的保守性,该研究为开发新型抗菌策略提供了潜在靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘