
-

生物通官微
陪你抓住生命科技
跳动的脉搏
质子化驱动粘附的仿生水凝胶:突破极端酸性环境下的组织修复难题
【字体: 大 中 小 】 时间:2025年09月05日 来源:Cell Reports Physical Science 7.3
编辑推荐:
为解决传统水凝胶在强酸环境(pH≈2)下粘附力弱、结构易降解的问题,Yang等受胃粘膜启发开发了超稳定仿生水凝胶(UMIH)。该材料通过高等电点蛋白(HIP)质子化驱动静电相互作用、单宁酸(TA)氢键网络和六亚甲基二异氰酸酯(HDI)共价交联的协同作用,实现64.7 kPa的湿态粘附强度(pH 2下为临床用磷酸铝凝胶的15倍),并在7天内保持结构稳定。动物实验证实其能促进食管上皮重塑和血管生成,为胃肠道疾病治疗提供新策略。
极端酸性环境下的组织粘附困境
胃酸环境(pH≈2)是生物医学材料面临的"禁区",传统水凝胶在此条件下会因网络降解而失效。尽管水凝胶因其生物相容性和柔韧性在医疗领域备受青睐,但酸性环境导致的粘附力丧失和结构崩塌,使其难以应用于胃溃疡、食管反流等疾病的治疗。临床常用的磷酸铝凝胶(APG)粘附强度仅4.3 kPa,无法满足长期组织修复需求。
胃粘膜的仿生启示
自然界中,胃粘膜通过富含碱性氨基酸的黏液蛋白在强酸环境下形成保护层。受此启发,香港理工大学Zuankai Wang(王钻开)团队联合多机构开发了超稳定仿生水凝胶(UMIH)。该成果发表于《Cell Reports Physical Science》,通过分子层面的仿生设计,实现了"质子化增强粘附-酸中和-动态降解"三重突破。
关键技术方法
研究采用高等电点重组蛋白ELR-IK24(HIP)作为质子化基质,与单宁酸(TA)通过液相分离形成共凝聚体,再经六亚甲基二异氰酸酯(HDI)共价交联构建双网络结构。通过分子动力学模拟分析质子化界面相互作用,采用生物3D打印动态胃模型评估功能持续性,并在大鼠和猪食管损伤模型中验证治疗效果。
研究结果
UMIH的分子设计与网络结构
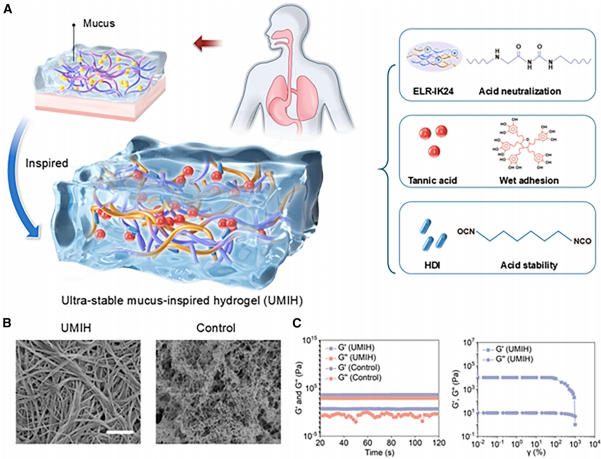
UMIH创新性地整合了三种组分:含24个连续赖氨酸的ELR-IK24蛋白(HIP)在pH 2时质子化产生+0.021 e/nm2表面电荷密度;TA提供16个酚羟基形成氢键网络;HDI构建共价交联骨架。扫描电镜显示其纤维直径约100 nm,显著优于无序结构的对照组。流变测试表明储能模量达103 Pa,具备剪切稀化特性,适合内镜下注射。
强酸环境下的粘附性能

在pH 2条件下,UMIH的湿态粘附强度达64.7±8.3 kPa,较对照组(36.8±2.2 kPa)和APG提升75%和15倍。分子模拟显示质子化的赖氨酸残基与TA形成密集静电网络。酸中和测试表明其可缓冲28.51 mL盐酸,断裂能(Gc)达397 J/m2,7天后仍保持50%以上质量。
胃肠道疾病治疗的体外验证
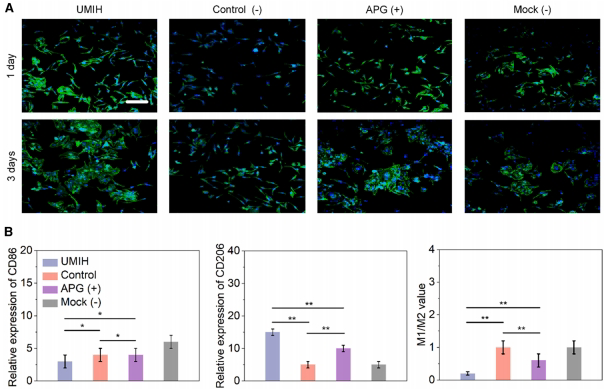
UMIH促进Het-1A食管上皮细胞增殖(72小时达对照组2.1倍),并通过下调CD86 42.7%、上调CD206 68.3%诱导巨噬细胞向M2型极化。抗菌实验显示其对大肠杆菌和金黄色葡萄球菌的抑制率超90%。
动物模型治疗效果
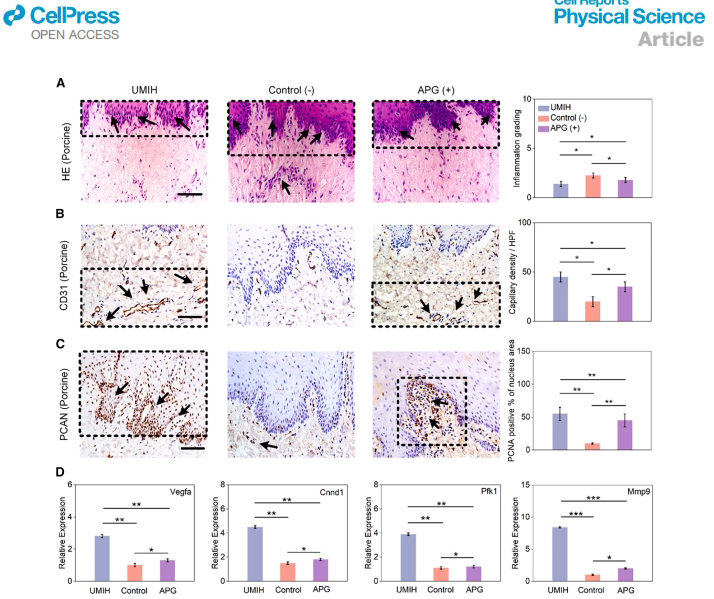
在猪食管损伤模型中,UMIH组毛细血管密度(52.3±6.8个/mm2)显著高于APG组,PCNA阳性细胞比例达68.5%。转录组分析显示Vegfa(血管生成)、Cend1(增殖)、Pfk1(代谢)和Mmp9(基质重塑)基因表达分别上调3.3-9.5倍。Western blot证实其通过激活PI3K/AKT通路促进修复。
研究结论与展望
该研究开发的UMIH突破了极端酸性环境下生物粘附材料的性能极限,其创新性体现在:①首创质子化驱动粘附机制,解决酸环境界面相容性问题;②通过HDI-TA双网络实现7天级功能持续性;③兼具抗菌(膜破坏作用)和免疫调节(M2极化)功能。每10克材料成本低于8美元,适合转化应用。未来可拓展至酸响应药物递送系统和可穿戴生物电子器件开发,为消化系统疾病治疗提供全新解决方案。
 生物通微信公众号
生物通微信公众号
知名企业招聘