
-

生物通官微
陪你抓住生命科技
跳动的脉搏
海洋海绵来源Onnamides及其新型类似物Onnamide G作为强效抗利什曼药物的发现与研究
【字体: 大 中 小 】 时间:2025年09月06日 来源:Marine Biotechnology 2.8
编辑推荐:
本研究针对利什曼病治疗药物匮乏的现状,从日本冲绳海域Theonella sp.海绵中分离获得onnamides系列化合物,包括新型结构onnamide G。通过体外活性评价发现6,7-dihydro-onnamide A(IC50=0.2 nM)等化合物展现出显著抗利什曼原虫活性,且选择性指数(SI)达117-1067倍。结构-活性关系(SAR)分析揭示了关键药效团特征,作用机制研究表明其作用途径不同于两性霉素B。该研究为开发新型抗利什曼药物提供了重要先导化合物。
在全球热带地区,一种名为利什曼病(Leishmaniasis)的寄生虫病正威胁着约3.5亿人口的健康。这种由利什曼原虫(Leishmania)引起的疾病,不仅导致皮肤溃疡、黏膜损伤等严重症状,更因现有治疗药物存在毒性大、耐药性强等问题,使得临床治疗陷入困境。面对这一挑战,来自冲绳的海洋生物资源为科学家们提供了新的研究方向——海洋海绵中蕴藏的onnamides类化合物,可能成为突破现有治疗瓶颈的关键。
在《Marine Biotechnology》最新发表的研究中,由Takahiro Jomori和Kanami Mori-Yasumoto领衔的联合研究团队,从日本冲绳Manza海域采集的Theonella sp.海绵中,成功分离获得8种onnamides类化合物,包括1个新结构onnamide G(8)。研究采用生物活性导向分离策略,结合核磁共振(NMR)和高分辨质谱(HRESIMS)进行结构鉴定,通过WST-8法评价抗利什曼活性,并开展结构-活性关系(SAR)分析和作用机制研究。
研究团队采用多学科交叉方法:通过柱层析和反相高效液相色谱(RP-HPLC)从海绵提取物中分离活性成分;运用500 MHz NMR和Orbitrap高分辨质谱解析化合物结构;以Leishmania major promastigotes为模型,采用Cell Counting Kit-8检测抗寄生虫活性;通过HepG2和RAW264.7细胞系评价细胞毒性;设计特殊实验比较onnamide A(1)与两性霉素B(AmB)的作用机制差异。
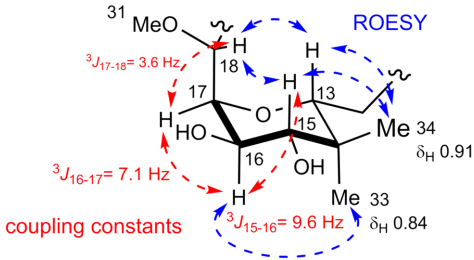
新化合物onnamide G(8)的分子式为C38H63N5O12,与onnamide A(1)相比缺少一个甲氧基,形成独特的双环核心结构。通过核磁数据分析和二维谱图(包括1H-1H COSY、HMBC和ROESY)确定了其平面结构和相对构型,特别是通过ROESY相关确定了四氢吡喃环的椅式构象。
所有测试化合物均显示出显著抗利什曼活性:
6,7-dihydro-onnamide A(4)活性最强(IC50=0.2 nM)
onnamide A(1)次之(IC50=1.2 nM)
活性远超临床药物两性霉素B(IC50 0.1μM)和米替福新(IC50 8.3μM)
细胞毒性测试显示优异的选择性指数(SI),其中onnamide A(1)对HepG2细胞的SI达1067倍,满足WRAIR和DNDi机构的开发标准。
研究揭示了关键药效特征:
侧链双键还原显著增强活性(4 vs 1)
C-22位缩醛结构对活性至关重要(9活性降低20倍)
精氨酸(Arg)残基的存在提升抗利什曼活性(10活性仅为1的1/25)
18和16位缩醛结构对活性起决定性作用(7活性显著降低)
通过ergosterol(Erg)结合实验发现:
两性霉素B活性随Erg浓度增加而降低,证实其通过结合Erg发挥作用
onnamide A(1)活性不受Erg影响,表明其作用机制独立于Erg途径

该研究首次系统报道了onnamides类化合物的抗利什曼活性,发现6,7-dihydro-onnamide A(4)等化合物具有纳摩尔级活性和优异的选择性。不同于传统药物两性霉素B,onnamides通过独特机制发挥作用,为开发新型抗利什曼药物提供了全新思路。
尽管这些复杂天然产物的规模化生产面临挑战,但研究者指出可通过培养海绵或利用已发现的产onnamide类似物的Labrenzia sp. PHM005细菌实现可持续供应。未来研究将聚焦体内活性评价和详细机制解析,推动这类海洋天然产物向临床药物转化。
 生物通微信公众号
生物通微信公众号
知名企业招聘