
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:细胞外囊泡的生物发生机制及其对肿瘤免疫微环境的影响
【字体: 大 中 小 】 时间:2025年09月06日 来源:Journal of Biomedical Science 12.1
编辑推荐:
这篇综述深入探讨了细胞外囊泡(EVs)的异质性生物发生机制及其在肿瘤免疫微环境(TIME)中的双重调控作用。文章系统梳理了外泌体(exosomes)、微泡(microvesicles)等典型EVs及迁移体(migrasomes)等非典型EVs的形成途径,重点解析了ESCRT复合物、四跨膜蛋白(tetraspanins)等关键分子在EVs生成和PD-L1等免疫检查点分子分选中的作用。作者还总结了肿瘤源性EVs(TEVs)通过递送miRNA、circRNA等核酸或PD-L1/TGF-β等蛋白重塑TIME的机制,并展望了EVs作为液体活检标志物和药物载体的临床应用挑战。
细胞外囊泡(EVs)是由几乎所有细胞类型释放的纳米级膜泡,根据起源和大小可分为外泌体(50-150 nm)、微泡(100-1000 nm)和凋亡小体(>1000 nm)等。外泌体通过多泡体(MVBs)与质膜融合释放,其形成依赖ESCRT复合物(Endosomal Sorting Complex Required for Transport)或非经典途径如神经酰胺(ceramide)诱导的膜弯曲。其中,ESCRT-0通过泛素化识别货物(如PD-L1),而ESCRT-III驱动膜剪切。有趣的是,ALIX蛋白与syndecan-syntenin形成的三元复合物可替代ESCRT-0功能,促进特定外泌体亚群分泌。
微泡则通过质膜出芽产生,涉及Rho/ROCK信号和I-BAR结构域蛋白(如MIM)介导的膜变形。近期发现的迁移体(migrasomes)则源自细胞迁移时收缩纤维末端的膜膨大,其形成需Tspan4富集的膜微域和Rab35-PI(4,5)P2轴调控。这些EVs亚群的生物发生机制差异决定了其携带的核酸(如miR-21-5p)、蛋白(如CD63)和代谢物(如腺苷)组成。
肿瘤源性EVs(TEVs)通过递送免疫调节分子重塑TIME。例如:
T细胞耗竭:黑色素瘤外泌体中的PD-L1结合CD8+T细胞的PD-1,抑制其细胞毒性;结直肠癌EVs携带的circCCAR1则稳定PD-1 mRNA,导致免疫治疗耐药。
巨噬细胞极化:卵巢癌EVs的circATP2B4通过激活SREBF1/PI3K-AKT通路促进M2型极化;而胶质母细胞瘤EVs的miR-25则抑制cGAS-STING信号,削弱M1型抗肿瘤活性。
NK细胞抑制:肝癌EVs递送miR-17-5p下调NKG2D受体,而急性髓系白血病EVs的PD-L1直接抑制NK细胞活化。
免疫细胞衍生的EVs同样影响肿瘤进展。CD8+T细胞EVs通过FasL诱导肿瘤基质细胞凋亡,而M1巨噬细胞EVs的miR-150可抑制胶质瘤MMP16表达。相反,MDSC EVs的TGF-β1促进Treg扩增,形成免疫抑制性微环境。
EVs作为液体活检标志物已用于前列腺癌(ExoDx?检测)和肺癌(Guardant360?)诊断。在治疗方面,装载KRASG12D siRNA的间充质干细胞EVs(NCT03608631)和DC衍生的抗原呈递EVs(NCT01159288)已进入临床试验。然而,EV异质性和规模化生产仍是转化医学的主要瓶颈。
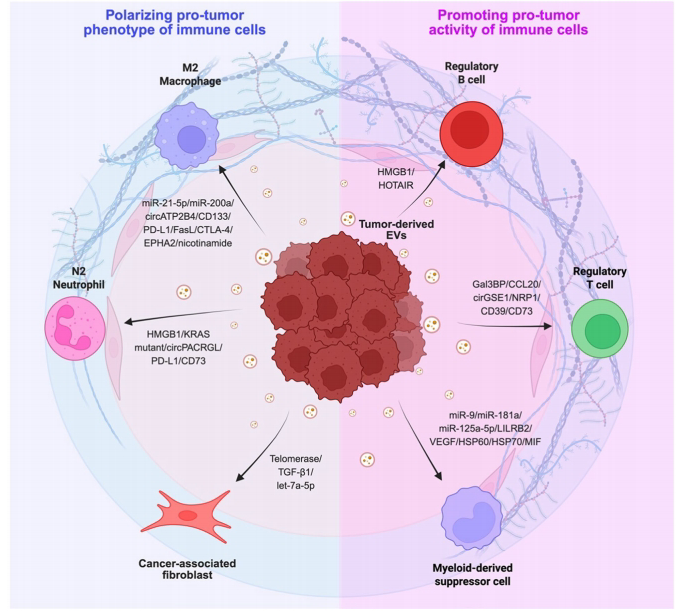
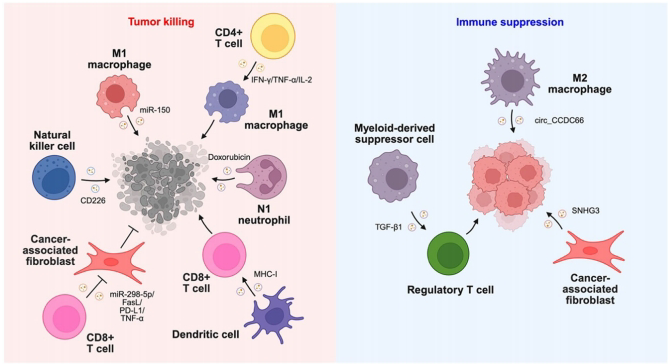
未来研究需进一步解析EV生物发生与货物分选的精确调控,并开发靶向特定EV亚群的策略,以突破当前肿瘤免疫治疗的局限性。
 生物通微信公众号
生物通微信公众号
知名企业招聘