
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于酵母TAR克隆技术的PRRSV荧光标记病毒构建及抗病毒药物筛选研究
【字体: 大 中 小 】 时间:2025年09月06日 来源:npj Viruses
编辑推荐:
本研究针对猪繁殖与呼吸综合征病毒(PRRSV)反向遗传操作效率低下的问题,创新性采用酵母转化相关重组(TAR)克隆技术,成功构建了GFP标记的PRRSV-1/2感染性克隆。研究发现TRS6转录调控序列是外源基因稳定表达的关键元件,并通过AlphaFold预测的RdRp结构揭示了瑞德西韦等SARS-CoV-2抗病毒药物对PRRSV的跨科抑制作用机制,为动脉炎病毒载体疫苗开发提供了新技术平台。
猪繁殖与呼吸综合征病毒(PRRSV)作为全球养猪业最具破坏性的病原体之一,每年造成数十亿美元经济损失。这种动脉炎病毒科(Arteriviridae)成员具有高度变异性,其复杂的转录调控机制和有限的体外研究工具严重制约了疫苗研发进程。传统反向遗传系统存在克隆步骤繁琐、基因组不稳定等问题,而新兴的"感染性亚基因组扩增子"(ISA)方法又面临病毒种群异质性大的挑战。
为解决这些技术瓶颈,Minze Zhang等研究者创新性地将酵母转化相关重组(TAR)克隆技术应用于PRRSV研究。这项发表于《npj Viruses》的研究通过巧妙设计,仅用一周时间就完成了从cDNA克隆构建到病毒拯救的全流程,较传统方法效率提升显著。研究团队首先成功构建了PRRSV-1(Lelystad株)和PRRSV-2(XH-GD株)的全长感染性克隆,随后在ORF1-ORF2和ORF7-3'UTR两个位点插入GFP表达盒,系统比较了不同转录调控序列(TRS)对外源基因表达的影响。
关键技术包括:酵母TAR克隆系统快速组装病毒基因组、HEK 293T/MARC-145细胞系病毒拯救、流式细胞术检测GFP表达、TCID50测定病毒滴度,以及基于AlphaFold的PRRSV RNA依赖的RNA聚合酶(nsp9)结构预测。特别值得注意的是,研究采用了来自广东新会的高致病性PRRSV-2毒株(XH-GD)和欧洲原型PRRSV-1毒株(Lelystad)进行平行比较。
研究结果部分的重要发现包括:
"Construction of infectious clones of PRRSV-1 and PRRSV-2 by TAR cloning"
通过TAR克隆成功构建的rLV和rXH-GD病毒在MARC-145细胞中分别达到106和108 TCID50/mL的峰值滴度,生长动力学与亲本株无显著差异。
"Construction and characterization of GFP reporter PRRSV-1 and PRRSV-2"
发现TRS6序列种属特异性显著影响GFP稳定性:PRRSV-2的GD-7'GFP可稳定传代8次,而PRRSV-1的LV-1'GFP仅维持4代。将PRRSV-1的TRS6替换为PRRSV-2同源序列后,GFP表达稳定性提升至19代。
"Antiviral assay using GFP reporter PRRSV-1 and PRRSV-2"
抗病毒筛选显示:瑞德西韦对PRRSV-1/2的IC50分别为6.78μM和13.50μM;其活性代谢物GS-441524效果更佳(1.39μM和1.21μM);而莫努匹拉韦对PRRSV-1(100.7μM)效果优于PRRSV-2(910.8μM)。
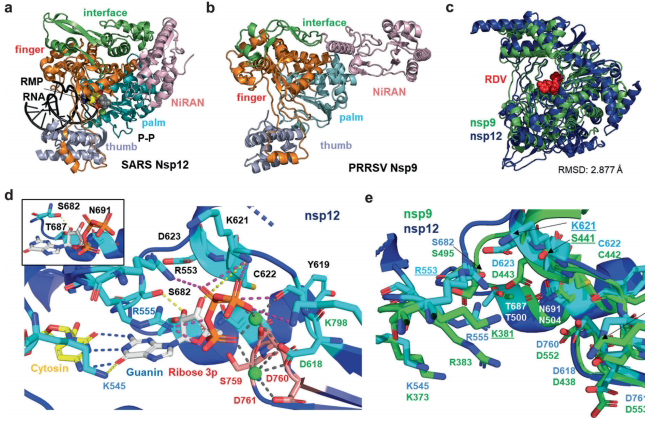
"Structural comparison of SARS-CoV-2 nsp12 and PRRSV nsp9"
AlphaFold预测显示PRRSV nsp9与SARS-CoV-2 nsp12的RdRp核心结构域RMSD仅3?,关键催化残基(S759-D760-D761)完全保守,解释了核苷类似物的交叉抑制作用。
讨论部分指出,该研究首次将TAR克隆技术成功应用于动脉炎病毒系统,建立的GFP报告病毒为高通量药物筛选提供了重要工具。结构生物学分析揭示:尽管PRRSV与SARS-CoV-2蛋白酶结构差异导致GC376无效,但RdRp催化中心的进化保守性使瑞德西韦等广谱抗病毒药物具有跨科应用潜力。特别值得注意的是,TRS6序列的种属特异性优化为动脉炎病毒载体疫苗设计提供了关键参数,而ORF1-ORF2被确定为外源基因插入的理想位点。这些发现不仅推进了对PRRSV分子生物学的理解,也为相关人畜共患RNA病毒的防控策略提供了新思路。
 生物通微信公众号
生物通微信公众号
知名企业招聘