
-

生物通官微
陪你抓住生命科技
跳动的脉搏
骨钙素γ-羧基化机制的结构解析:多界面协同作用与代谢调控新视角
【字体: 大 中 小 】 时间:2025年09月06日 来源:Cell Research 25.9
编辑推荐:
本研究通过冷冻电镜技术解析了骨钙素前体与维生素K依赖性γ-羧化酶(GGCX)的复合物结构,揭示了其通过C端螺旋与酶形成独特疏水相互作用的新机制。该发现阐明了骨钙素区别于凝血因子的低效羧化原理,为开发选择性调控骨钙素生物活性的代谢疾病治疗策略提供了结构基础。
骨骼不仅是人体的支撑结构,更是一个活跃的内分泌器官。骨钙素(osteocalcin)作为骨组织中最丰富的非胶原蛋白,其γ-羧基化修饰状态直接决定了它的双重命运:完全羧化的骨钙素(cOCN)参与骨矿化,而部分羧化的形式(ucOCN)则作为激素调节糖代谢和认知功能。这种神奇的"变身"能力依赖于维生素K依赖性γ-羧化酶(GGCX)的精确调控,但长期以来科学家们困惑于:为何骨钙素的羧化效率显著低于凝血因子?
传统认知中,GGCX通过识别凝血因子前肽的高保守序列(FX5AX3L)实现高效羧化。然而骨钙素前肽(EX5GX3V)却打破了这一规律,其结合能力弱且无法激活酶活性。更令人费解的是,去除前肽的成熟骨钙素仍能被羧化,暗示存在未知的识别机制。这些谜团不仅关乎基础生物学认知,更具重要临床意义——选择性调控骨钙素羧化程度可能成为治疗代谢疾病的新靶点。
为破解这一难题,Cao等研究团队在《Cell Research》发表的研究中,创新性地将前骨钙素与GGCX构建为融合蛋白,通过冷冻电镜(cryo-EM)成功解析了3.2?分辨率的复合物结构。技术路线的巧妙之处在于:利用哺乳动物细胞表达系统确保蛋白质正确折叠,通过融合策略克服弱相互作用复合物的制备难题,结合冷冻电镜技术捕获动态互作细节。
结构揭示多界面协同机制
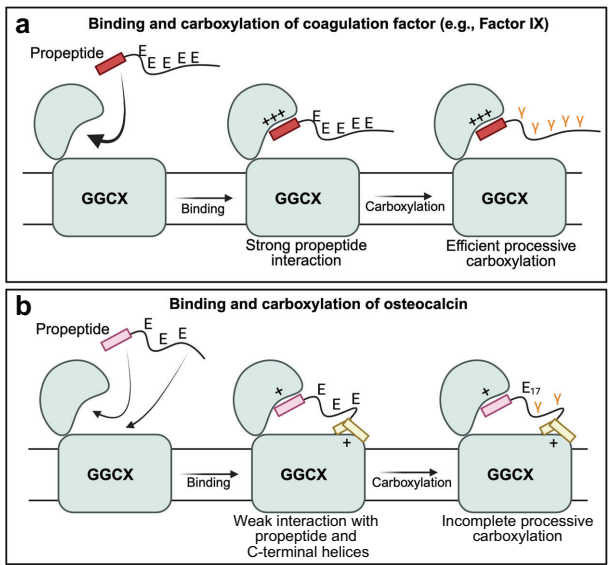
高分辨率结构显示,骨钙素以部分折叠构象通过"三明治"式相互作用结合GGCX:
1)前肽区域虽缺乏保守序列,但在成熟区域存在时仍能稳定结合;
2)成熟区C端形成L型双螺旋结构,精准嵌入GGCX的互补疏水凹槽;
3)点突变实验证实,破坏疏水相互作用可使维生素K环氧化活性降低70%,证明该界面对酶活调控的关键作用。
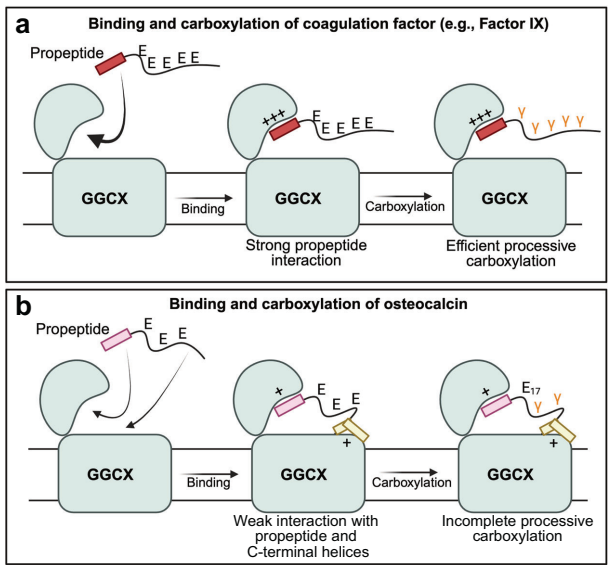
羧化效率差异的结构基础
与凝血因子IX的对比研究揭示本质差异:
凝血因子:依赖前肽强结合(+++)实现完全羧化
骨钙素:通过前肽(+)和C端螺旋(+)的弱协同作用,导致Glu17位点选择性漏羧
生理与治疗意义
该研究阐明了骨细胞调控骨钙素激素活性的结构基础:低效羧化机制使骨钙素天然存在羧化异质性,Glu17位点的选择性漏羧恰好产生具有代谢调控功能的ucOCN。这解释了为何运动、应激等生理状态可动态调节血清ucOCN水平。更引人瞩目的是,针对GGCX-骨钙素C端互作界面的药物设计,可能实现选择性增强骨钙素激素活性而不影响凝血功能的精准治疗策略,为糖尿病、阿尔茨海默病等代谢相关疾病提供新思路。
这项研究不仅破解了骨钙素羧化调控的结构密码,更揭示了GGCX识别底物的多样性机制。后续研究发现,胰腺β细胞表达的ERGP蛋白也采用类似骨钙素的多弱相互作用模式,暗示该机制在代谢调控蛋白中的普适性。这些突破性认识为维生素K依赖性蛋白质的精准调控开辟了新维度。
 生物通微信公众号
生物通微信公众号
知名企业招聘