
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于基础模型的病理图像空间转录组学生成方法FmH2ST:突破肿瘤异质性解析与基因调控网络推断的技术瓶颈
【字体: 大 中 小 】 时间:2025年09月10日 来源:Nucleic Acids Research 13.1
编辑推荐:
本研究针对空间转录组学(ST)数据成本高、组织切片间异质性(inter-slice heterogeneity)和切片内复杂关系(intra-slice complexity)解析不足等挑战,开发了基于基础模型的双分支框架FmH2ST。通过整合病理基础模型先验知识与局部斑点特征,结合多级特征提取和双图策略,显著提升了基因表达预测精度(PCC提升27-33%)。该方法不仅能有效去噪原始数据、揭示癌症空间异质性,还可支持基因共表达分析和调控网络(GRN)推断,为临床诊断和个性化治疗提供新工具。
研究背景与意义
空间转录组学(Spatial Transcriptomics, ST)技术虽能同时保留基因表达信息和空间位置,但其高昂的成本和复杂的技术流程严重限制了临床应用。病理切片图像(如H&E染色)作为临床常规检测项目,蕴含着丰富的组织结构信息,如何从中预测空间基因表达成为突破ST技术瓶颈的新思路。然而现有方法面临三大困境:缺乏大规模病理数据预训练的先验知识、难以捕捉不同切片间的异质性(inter-slice heterogeneity)、对切片内复杂空间关系(intra-slice complexity)建模不足。这些缺陷导致预测结果在癌症空间异质性解析、基因共表达模式识别等关键应用场景中表现欠佳。
关键技术方法
研究团队开发了FmH2ST双分支框架:1)基础模型分支采用病理基础模型①提取多级特征,通过空间图(spatial graph)和可学习特征图(feature graph)建模复杂关系;2)斑点特异性分支结合多尺度卷积、Transformer和图注意力网络(Graph Attention Network, GAT)提取局部特征。使用来自7例HER2+乳腺癌患者(32个切片)和4例皮肤鳞状细胞癌(cSCC)患者(12个切片)的ST数据进行留一法验证。
主要研究结果
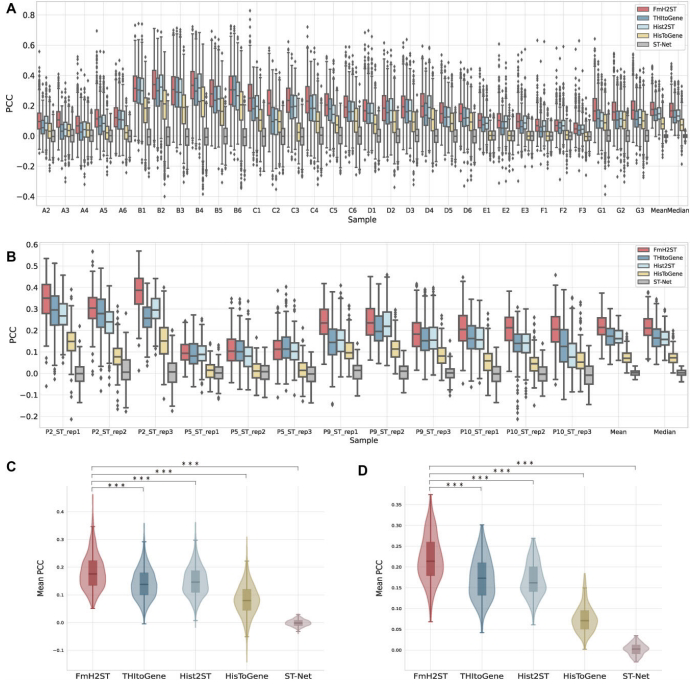
1. FmH2ST实现空间基因表达精准预测
在HER2+和cSCC数据集上,FmH2ST的Pearson相关系数(PCC)分别比最优基线方法THItoGene提高33.8%和28.4%(图3)。特别在难例样本(如患者G的G1-G3切片)中,基础模型分支通过外部先验知识显著提升预测稳定性。
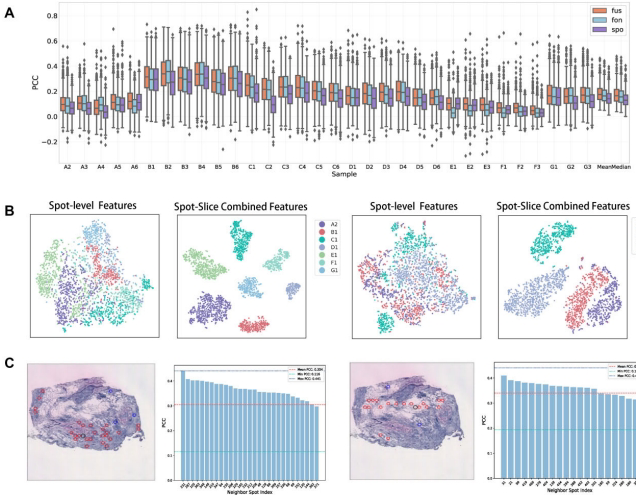
2. 双分支架构验证与技术突破
全局特征整合:通过t-SNE可视化证实,融合切片级全局特征后,不同切片斑点特征呈现更清晰的边界(图4B),解决了切片间异质性难题。
可学习特征图:图4C显示特征图能连接空间离散但生物学相似的斑点(红色节点),其基因表达PCC值显著高于随机配对(粉色虚线)。
3. 癌症相关基因与功能解析
预测最准确的基因(如FN1、SCD、FASN)均被报道与乳腺癌密切相关(图5)。GO分析显示TOP50基因显著富集于NADH相关酶(P=1.2×10-8)和MHC蛋白复合体(P=3.4×10-6),KEGG通路分析揭示Th1/Th2细胞分化等癌症相关通路(图6)。
4. 空间域重建与表达去噪
在病理标注的6个切片中,FmH2ST聚类结果与金标准的一致性(ARI)比原始数据提高22%(图7)。如图8所示,预测表达能清晰识别原始数据中模糊的癌区边界(如切片E1中三个癌区),证实其去噪增强效果。
5. 基因共表达与GRN推断提升
共表达分析显示FmH2ST更好保留生物学相关模块(图9)。基于预测数据构建的GRN具有更优的无标度特性(R2=0.874 vs 0.787),并鉴定出CUX1、IKZF3等乳腺癌关键转录因子(图10)。
结论与展望
FmH2ST通过创新性地整合病理基础模型与双图学习策略,首次实现了:1)利用切片级上下文解决组织异质性;2)通过可学习特征图建模非邻近相似斑点的语义关系。该方法不仅为ST数据提供了经济高效的替代方案,其预测结果在癌症空间异质性解析、基因调控网络推断等场景展现出超越原始数据的生物学洞察力。未来可扩展至单细胞分辨率ST平台,为肿瘤微环境研究提供新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘