
-

生物通官微
陪你抓住生命科技
跳动的脉搏
神经炎症在LPA诱导的出血后脑积水优化模型中的作用机制及小胶质细胞靶向治疗新策略
【字体: 大 中 小 】 时间:2025年09月20日 来源:Neurochemical Research 3.8
编辑推荐:
本研究针对出血后脑积水(PHH)缺乏有效药物治疗的临床难题,通过优化LPA诱导的小鼠模型,结合蛋白质组学、单核RNA测序和细胞特异性耗竭实验,揭示了小胶质细胞激活通过神经免疫-神经血管互作机制驱动PHH的关键作用,为开发靶向神经炎症的PHH治疗策略提供了重要理论依据。
在早产儿神经系统疾病中,出血后脑积水(Post-hemorrhagic hydrocephalus, PHH)是一种严重影响患儿生存质量的疾病。当早产儿发生三级及以上脑室内出血时,血液进入侧脑室,引发脑脊液(Cerebrospinal Fluid, CSF)异常积聚,导致脑室扩大和颅内压升高。目前PHH的治疗主要依赖脑室-腹腔分流术等侵入性手术,不仅存在感染、堵塞等风险,更缺乏能够改变疾病进程的药物疗法。这种临床困境背后的核心原因是:PHH发生和发展的分子机制尚未完全阐明。
近年来,溶血磷脂酸(Lysophosphatidic Acid, LPA)信号通路被发现在PHH发病机制中扮演关键角色。LPA是一种生物活性磷脂分子,通过G蛋白偶联受体(LPA1-6)介导多种细胞反应。在出血性事件后,脑脊液中LPA浓度可从纳摩尔级升高到微摩尔级。先前研究证实,向小鼠脑室内注射LPA可成功模拟人类PHH的病理特征,包括脑室扩大、室管膜细胞损伤和免疫细胞浸润。然而,这些模型使用的LPA浓度较高,与生理病理相关性存在差距,且对神经炎症机制的系统性研究仍不充分。
为了解决这些问题,由Paloma Sanchez-Pavon和Carter R. Palmer共同领导的研究团队在《Neurochemical Research》上发表了最新研究成果。他们通过优化LPA诱导的PHH小鼠模型,结合多组学分析和细胞特异性干预策略,深入揭示了神经炎症特别是小胶质细胞激活在PHH中的驱动作用,为开发靶向神经免疫机制的治疗方案提供了新思路。
研究人员采用了几项关键技术方法:使用优化浓度(1mM)的LPA在 postnatal day 7(P7)小鼠进行脑室内注射建立PHH模型;通过 tandem mass tag(TMT)标记质谱技术对脑脊液进行蛋白质组学分析;采用10x Genomics单核RNA测序(snRNA-seq)技术解析脑组织细胞类型的转录组变化;利用PLX3397(Pexidartinib)进行小胶质细胞特异性耗竭实验;并通过组织学分析、细胞因子阵列和生物信息学分析进行多维度验证。
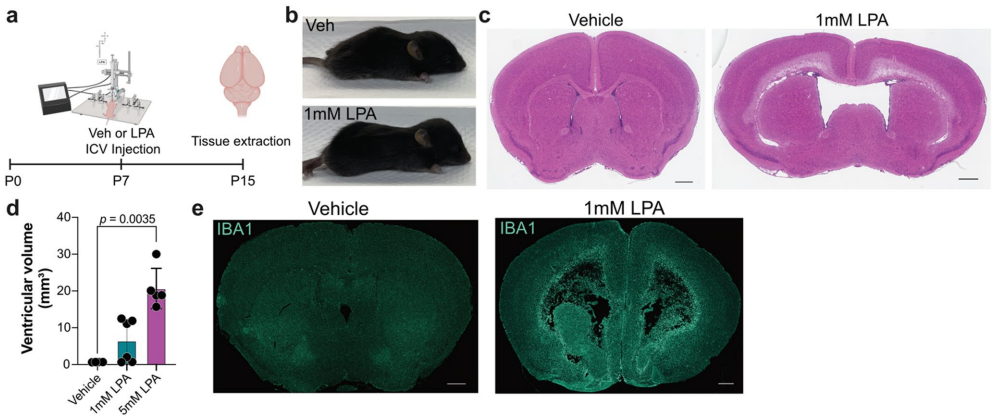
研究团队对LPA诱导的PHH模型进行了重要优化:使用0.01%牛血清白蛋白(BSA)作为载体,将LPA注射浓度从5mM降低到更生理相关的1mM;将注射时间从 postnatal day 8(P8)调整为P7,以更好地模拟人类早产儿的发育阶段。这种优化模型成功复制了人类PHH的主要特征:脑脊液积累引起的头颅肿胀和变形、侧脑室明显扩大以及可量化的脑室扩大。免疫荧光检测发现,LPA注射后8天,脑室周围IBA1阳性细胞(小胶质细胞/巨噬细胞)显著增加,表明小胶质细胞激活持续存在。
为了识别参与PHH炎症传播的潜在蛋白介质,研究人员提取了vehicle注射和LPA注射小鼠的脑脊液,进行了广泛的蛋白质组学分析和细胞因子/趋化因子阵列检测。蛋白质组学分析鉴定出2000多个在LPA注射后8天显著失调的蛋白质。基因本体(GO)分析显示,1mM LPA注射改变了参与多种通路蛋白质的丰度:与神经系统发育和细胞连接相关的蛋白质上调,而与血管发育、伤口愈合和体液调节相关的蛋白质减少。趋化性和体液免疫等关键免疫应答通路中的蛋白质也显著受影响,表明功能失调的免疫和血管反应在LPA诱导的PHH中起作用。

通过Discovery Assay Cytokine Array分析获得更高的细胞因子/趋化因子检测灵敏度。在分析的44种蛋白质中,15种在LPA注射后8天的脑脊液中显著增加。许多是被认为是招募先天免疫细胞(中性粒细胞、巨噬细胞、嗜酸性粒细胞或嗜碱性粒细胞)的促炎趋化因子:CCL2(MCP-1)、CCL3(MIP-1a)、CCL4(MIP-1β)、CCL5(RANTES)、CCL11(Eotaxin-1)、CCL12(MCP-5)和CXCL1(KC)。其他显著增加的趋化因子已知可调节T细胞迁移和随后的免疫反应:CXCL9(MIG)、CXCL10(IP-10)、CCL17(TARC)、CCL19(MIP-3β)和CCL22(MDC)。
为了以无偏见的方式分析脑积水脑细胞类型及其激活状态,研究人员采用了单核RNA测序(snRNA-seq)技术。去除小脑和嗅球后,分离纯化细胞核,使用10x Genomics 3' Gene Expression试剂盒进行处理。核被聚类,标签从参考数据集转移,从而识别出六种主要细胞群体:星形胶质细胞、室管膜细胞、免疫细胞、神经元、少突胶质细胞和血管细胞。
UMAP图显示,vehicle注射与LPA注射动物来源的核具有相似且大部分重叠的细胞类型簇。初步分析揭示了响应LPA的大脑中存在不同细胞类型比例的变化:星形胶质细胞和免疫细胞显著升高,而血管细胞显著减少。室管膜细胞、神经元和少突胶质细胞的比例在响应LPA时没有显著变化。
进一步分析揭示了当比较来自LPA注射新生鼠与vehicle对照的核时,六种细胞类型中基因表达的变化。响应LPA注射,血管细胞拥有最多上调和下调基因。血管功能障碍被认为是脑积水的可能驱动因素,因为它可能阻止有效排出多余脑脊液。为了进一步研究,血管细胞被亚聚类为周细胞、脑膜细胞和内皮细胞。亚聚类显示,脑膜细胞驱动了明显的血管转录组变化,它们有显著更多的DEG(97个),而周细胞只有22个,内皮细胞只有13个。这些上调的脑膜细胞基因的本体评估指向异常发育过程,可能来自大脑中观察到的显著结构破坏后的功能结构补偿性重组。
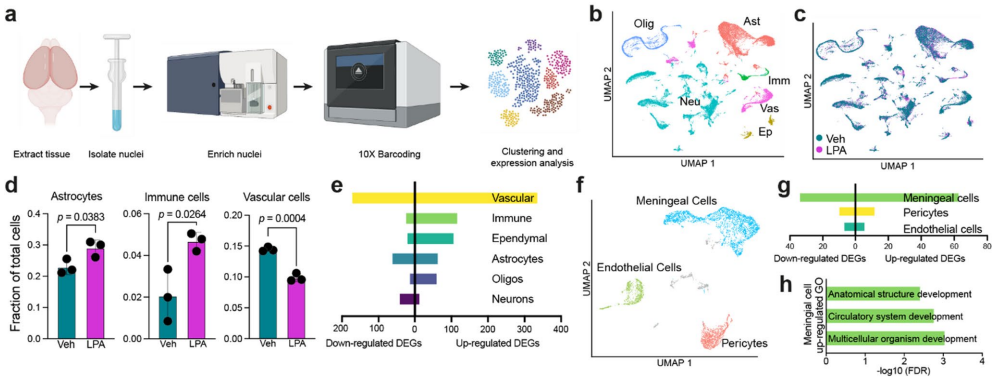
由于蛋白质组学和细胞因子阵列数据表明对LPA注射存在持续的神经炎症反应,免疫细胞被亚聚类以识别特定细胞类型。定义了三个群体,在vehicle注射和LPA注射大脑之间观察到明显的分离。一个群体被确定为外周巨噬细胞,基于存在标志物包括Lyvel、F13al,以及缺乏小胶质细胞特异性标志物Cx3cr1。另外两个群体,称为稳态小胶质细胞和激活小胶质细胞,都表达小胶质细胞标志物包括Cx3cr1,但通过不存在或存在小胶质细胞激活标志物包括Spp1、Apoe和Gpnmb来区分。
虽然外周巨噬细胞在这个时间点显著减少,但激活小胶质细胞占总免疫细胞群体的比例显著更多,而稳态小胶质细胞在响应LPA注射时没有变化。激活小胶质细胞与稳态小胶质细胞的显著增加 coincident with 激活小胶质细胞基因表达的变化。虽然巨噬细胞被确定只有一个DEG,稳态小胶质细胞有14个,但激活小胶质细胞的转录组被 dramatically altered。这个细胞亚群体有91个DEG,包括进一步增加激活标志物和丢失稳态标志物。
为了进一步表征来自LPA注射和vehicle注射大脑的激活小胶质细胞之间的差异,进行了GO分析。与信号转导、细胞迁移和伤口响应相关的通路受影响最大。这些数据与我们早期模型获得的数据相关,该模型显示小胶质细胞被激活并 actively recruited 到脑室边界以响应LPA诱导的脑积水。研究人员接下来将来自激活小胶质细胞的单核转录组数据与来自脑组织整体的蛋白质组数据进行了比较。这种分析识别出14个在mRNA和蛋白质水平上类似改变的基因,包括小胶质细胞激活标志物Spp1和Gpnmb。相比之下,稳态小胶质细胞只有一个具有协调的mRNA-蛋白质失调的基因,而巨噬细胞没有。这些数据共同表明,激活小胶质细胞数量的显著增加和LPA注射一周后持续存在的高度激活状态都有助于持续的炎症性脑积水状态。

研究人员假设激活的小胶质细胞是PHH发展和/或进展的关键。为了阐明小胶质细胞在LPA诱导的PHH模型中的作用,使用Pexidartinib(PLX3397)来耗竭发育中大脑的小胶质细胞。PLX3397是一种血脑屏障穿透性多靶点受体酪氨酸激酶抑制剂,能够消除小胶质细胞和巨噬细胞。
为了研究小胶质细胞耗竭对这个模型中PHH发展的影响,每天注射PLX3397(50 mg/kg)共15天(P1-P15),在P7进行LPA注射(5mM),8天后(P15)分离组织。使用更高剂量的LPA是为了在小胶质细胞在产生脑室扩大和神经炎症中的作用方面获得明确的答案。Iba1染色的免疫荧光成像证实,PLX3397给药在P7耗竭了小胶质细胞,如Iba1信号丢失所证明。
通过细胞因子阵列分析从vehicle注射、LPA注射和LPA/PLX3397注射大脑提取的CSF样本,研究了由于小胶质细胞缺失而引起的神经炎症细胞因子的变化。这种分析显示,即使在小胶质细胞耗竭后,炎症在LPA注射样本中仍然持续。然而,PLX3397给药显著降低了一些细胞因子水平到接近vehicle基线水平,包括CCL2(MCP-1)、CCL4(MIP-1b)、CCL12(MCP-5)、CCL22(MDC)、IL-16和IL-17。PLX3397诱导了CCL11(eotaxin)和CX3CL1(fractalkine)(涉及小胶质细胞募集的趋化因子)以及G-CSF和M-CSF(两者既是趋化因子也是骨髓生长因子)的显著增加,为小胶质细胞参与LPA诱导的炎症反应并被有效耗竭提供了支持证据。通常被认为是促炎的两个细胞因子,CXCL1(KC)和IFNg,也显著增加。常规T辅助细胞(Th)2型(Th2)细胞因子IL-3、IL-4、IL-5和IL-10都显著增加,而Th1相关的IL-16和Th17细胞因子IL-17都显著减少。细胞因子谱中的这些变化表明,PLX3397对骨髓细胞的耗竭将神经免疫环境从更促炎的Th1/Th17转变为可能抗炎的Th2。
PLX3397介导的小胶质细胞耗竭的影响也评估了对脑室容积的影响。与单独使用LPA相比,侧脑室在PLX3397/LPA组中似乎受损较轻。H&E染色切片和脑室容积量化也揭示了脑室扩大的显著减少。

研究结论表明,与神经炎症和神经血管变化相关的激活小胶质细胞是动物模型中PHH发展的重要贡献者。PLX3397对小胶质细胞的药理耗竭部分防止了侧脑室扩大,并改变了LPA诱导的脑积水小鼠模型中的神经炎症特征,该模型模拟了人类PHH的多个元素,并确定了小胶质细胞在促进PHH中的作用。LPA诱导的脑积水的蛋白质组学和转录组学变化可能有助于人类PHH中生物标志物的识别,与动物模型中观察到的CSF中细胞因子和趋化因子浓度的变化一致,这与人类疾病中观察到的神经炎症变化重叠。这些发现进一步验证了LPA诱导的PHH模型,并确定了可能通过针对神经免疫机制的药物干预进行治疗处理的关键疾病驱动因素。
与先前研究相比,本文中呈现的大多数数据是使用在更低、更生理相关浓度下给药的LPA获得的。这仍然导致了与先前模型中较高LPA浓度诱导的神经炎症反应相当的反应,但具有更反映人类疾病状态的宏观表型。有趣的是,我们的LPA暴露模型导致的蛋白质组变化也与人类疾病报告的变化重叠。
虽然蛋白质组数据识别了在CSF中失调的蛋白质,但转录组数据提供了对受LPA影响细胞类型的见解。我们能够识别P15小鼠大脑中许多受影响的细胞群体及其在响应LPA给药时的转录组变化。值得注意的是,在响应LPA暴露时,星形胶质细胞、血管细胞和免疫细胞是转录上改变最多的。
此外,血管细胞不仅数量显著减少,而且那些剩余的细胞中观察到的DEG数量是任何细胞类型中最高的。虽然细胞群体的减少可能归因于从脑积水大脑提取脑膜层的挑战,但它不能完全解释血管细胞类型中增加的DEG,这可能 underlie PHH中的血管和脑膜功能障碍。通过脑膜淋巴管将CSF引流到颈部淋巴结的CSF清除,包括促进CSF清除的基础脑膜淋巴管,因此,我们 implicating PHH中血管功能障碍的转录组数据与脑膜清除机制配对,与PHH中这种CSF清除途径的改变一致。
响应小胶质细胞耗竭的脑室扩大减少支持了它们在我们PHH模型中的参与。虽然PLX3397耗竭小胶质细胞以外的其他骨髓细胞类型可能 contribute to 这种效应,但小胶质细胞的丢失是显著且可重复的,与PLX3397诱导暴露和细胞耗竭后小胶质细胞和骨髓招募细胞因子的补偿性增加一致。减少的脑室扩大和支持性转录组与蛋白质组数据表明神经炎症小胶质细胞变化在PHH发展中的作用,与先前报告一致。
尽管小胶质细胞耗竭显示了显著的PHH相关表型减弱,但它未能完全解决由LPA注射诱导的观察到的变化,表明存在额外的细胞机制。有几种可能解释这种部分效应,可能对PHH的医学治疗具有临床相关性。虽然观察到许多促神经炎症标志物随着小胶质细胞去除而减少,但在细胞因子 panel 中仍然存在显著的炎症,这可能是星形胶质细胞在响应LPA注射时激活的结果。星形胶质细胞在其他神经系统疾病中具有关键的炎症作用,例如多发性硬化症,包括涉及LPA相关溶血磷脂鞘氨醇1-磷酸(S1P)受体介导信号传导的免疫过程。此外,虽然小胶质细胞耗竭和神经炎症减少可能潜在地减缓CSF产生,但对参与其清除的室管膜细胞和血管系统的损害可能抵消小胶质细胞耗竭的有益 effects。此外,虽然通常被认为与Th1或Th17免疫反应相比是"抗炎"的,但Th2反应仍然可以产生炎症。然而,Th2反应 clearly critical 在各种 setting 中的组织修复。CSF产生和清除之间可能存在动态相互作用,匹配来自多种细胞类型对每个的有意义贡献,导致该PHH模型中的脑室扩大以及其密切模拟的人类PHH。进一步值得注意的是,LPA和其他溶血磷脂如S1P具有超出此处识别的神经免疫和神经血管机制的独立免疫效应,进一步提高了靶向神经免疫机制和LPA信号通路在治疗PHH和可能其他形式脑积水的新型医学治疗的潜力。
 生物通微信公众号
生物通微信公众号
知名企业招聘