
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:肿瘤学中的精准表观遗传治疗
【字体: 大 中 小 】 时间:2025年09月20日 来源:Cancer and Metastasis Reviews 8.7
编辑推荐:
本综述系统探讨了表观遗传疗法在实体肿瘤治疗中的最新进展与挑战。文章聚焦组蛋白修饰(HPTMs)和DNA甲基化等机制,揭示了EZH2、HDAC等关键靶点在肿瘤转移和耐药性中的作用。作者提出基于液体活检(如Nu.Q?技术)的精准医疗策略,通过监测循环表观遗传标志物(如H3K27me3/H3K36me3)实现患者分层和治疗动态评估,为克服传统表观药物单药疗效局限提供了新型联合治疗方案(如EZH2i+免疫疗法)。
肿瘤的特征是极端的表型可塑性,即快速动态表型变化的能力[1]。这一特性导致耐药性和转移,成为癌症相关死亡的两个主要原因[2]。本综述聚焦导致癌症表型可塑性的可靶向表观遗传改变,提出优化肿瘤学中表观遗传疗法疗效的新治疗范式,以阻断转移进展并逆转耐药性。尽管该范式可应用于所有实体肿瘤,但我们将以三种最常见恶性肿瘤(乳腺癌、前列腺癌和肺癌)和肉瘤(唯一批准表观遗传疗法的实体癌)作为概念验证。
表观遗传学研究不源于DNA核苷酸序列改变的细胞表型可遗传变化[3]。主要表观遗传改变包括DNA甲基化、DNA羟甲基化和组蛋白翻译后修饰(HPTMs)。此处我们重点关注HPTMs,但讨论的大部分原理可推广到其他表观遗传机制。
哺乳动物基因组在结构上组织成DNA-蛋白质复合物,称为染色质[4]。染色质存在三种主要转录状态:[I] 常染色质,可被RNA聚合酶和转录因子接近,因此能主动转录;[II] 组成性异染色质,始终不可转录(如着丝粒和端粒);[III] 兼性异染色质,暂时不可转录。在发育过程中,谱系特异性由常染色质和兼性异染色质区域的动态调控支撑,从而实现细胞特异性基因表达谱。
核小体是染色质的基本单位,因此在表观遗传基因调控中起关键作用。核小体由四种主要核心组蛋白蛋白[H2A、H2B、H3和H4]的八聚体组成,周围缠绕147 bp的DNA。每个相邻核小体由约20-50 bp的自由DNA分隔。核小体蛋白由组蛋白H1稳定。每个核心组蛋白蛋白具有长的N末端尾,在表观遗传基因调控中起关键作用。这些尾部经历众多HPTMs,包括乙酰化、甲基化、磷酸化和泛素化。这些HPTMs的功能取决于修饰类型和受影响残基(表1)。例如,组蛋白乙酰化与开放染色质状态相关,因此与基因转录相关。组蛋白甲基化可具有相反效果,取决于受影响残基。组蛋白3的赖氨酸27(H3K27)可被单、二和三甲基化(分别为H3K27me、H3K27me2和H3K27me3),这导致基因沉默。另一方面,组蛋白H3K4me3标记主动转录[5]。HPTMs的组合复杂性在不同残基产生50多种不同修饰。值得注意的是,HPTMs不仅参与表观遗传基因调控,还参与DNA复制、修复、染色体浓缩和剪接[6]。HPTMs的表观遗传和非表观遗传功能之间复杂的相互作用尚未完全阐明。
每种HPTM由“写入器”、“擦除器”和“读取器”的动态相互作用维持[13]。例如,H3K27me3水平由EZH2(组蛋白甲基转移酶-写入器)和KDM6(组蛋白赖氨酸去甲基化酶-擦除器)的相反功能决定[14]。EED“读取器”结合H3K27me3并促进其他表观遗传因子的活性,从而控制基因表达[15]。“写入器”、“读取器”和“擦除器”的功能总结于(图1)。
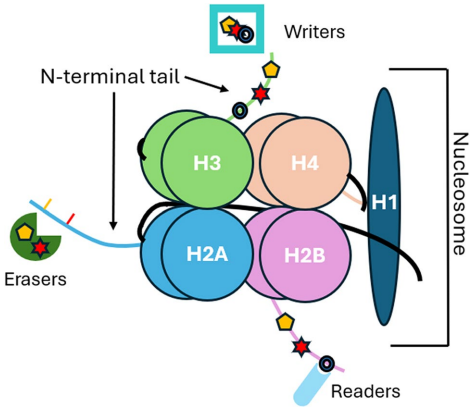
在人类寿命期间,表观遗传标记决定基因表达的时空差异,支撑胚胎发育、组织规范和器官功能。例如,DNA甲基化和HPTMs维持染色质稳定性,实现遗传印记和X染色体失活[19]。此外,表观遗传改变导致体细胞基因表达模式的可遗传变异,导致不同细胞类型的独特功能。值得注意的是,全基因组DNA甲基化和组蛋白修饰模式在早期发育过程中形成,并在多次细胞分裂中持续存在[20]。
除生理作用外,HPTMs可被癌症细胞劫持以促进肿瘤发生。大量研究表明,HPTMs在调节耐药性和转移中起关键作用。多项机制研究表明,转移进展和耐药性共享表型可塑性的关键分子机制。例如,上皮-间质转化(EMT),转移级联的早期步骤,直接调节凋亡基因的表达,从而影响耐药性[21]。此外,原发肿瘤中的转移起始细胞具有几种使耐药性成为可能的特征,包括进入和退出休眠的能力、代谢重编程和凋亡抗性[22]。这一证据体表明,转移和耐药性是深刻互连的现象,可能由共享的表观遗传机制实现。例如,H3K27me3写入器EZH2已被确定为从局部到转移性到激素治疗耐药性前列腺癌进展中上调最多的基因之一[23]。与我们的假设一致,EZH2抑制在转移性前列腺癌(PCa)中恢复恩杂鲁胺敏感性[24]。机制上,EZH2调节细胞周期和细胞分化标记的表达[25]。其中一些表观遗传效应由H3K27me3依赖性基因沉默介导。然而,EZH2也通过组蛋白甲基酶非依赖性机制起作用。例如,EZH2甲基化ERG转录因子,从而促进其激活。这有利于PCa细胞的侵袭性并促进转移[26]。EZH2也被证明在肺癌(LC)中促进上皮-间质转化(EMT)和耐药性[27]。EZH2在不同肉瘤亚型中也高表达[28],其沉默停止肉瘤细胞增殖[29]。虽然EZH2在PCa、LC和肉瘤中有利于致癌进展,但其在乳腺恶性肿瘤中的功能似乎相当不同。例如,Mieczkowska等[30]发现耐药乳腺癌(BC)细胞下调EZH2的表达。这导致促进癌细胞存活基因的重新激活。另一方面,缺氧条件激活BC细胞中的XBP1转录因子[31]。缺氧激活的XBP1招募EZH2到肿瘤抑制基因的启动子,从而有利于BC转移[32]。这些例子突出了表观遗传标记对细胞和微环境背景的关键依赖性。HPTMs在转移和耐药性中的参与不限于H3K27me3。例如,组蛋白去乙酰化酶(HDACs)是去除乙酰标记从而沉默基因表达的“擦除器”。人类基因组编码18种不同的HDACs[33]。每种HDAC异构体显示略微不同的底物特异性和亚细胞定位。特定的HDACs已被广泛涉及耐药性和转移,主要(但不 exclusively)作为癌基因。例如,HDAC2与EZH2合作诱导上述缺氧依赖性转移反应[31]。HDAC2还促进LC中的迁移和侵袭[33]。其他HDACs在致癌进展中的新兴作用已被最近综述[34]。
总之,这一证据表明HPTMs是癌症转移和耐药性的关键调节器,但它们的效果高度依赖于组织和微环境。因此,表观遗传酶,如擦除器和写入器,是有吸引力的治疗靶点,但它们的临床应用需要分子信息化的、定制的方法。
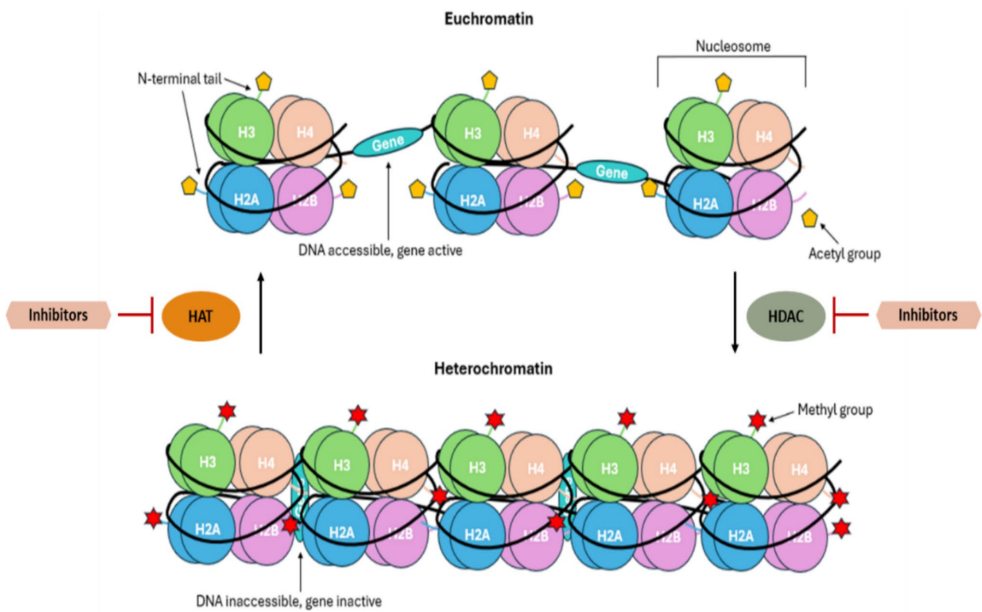
HPTMs已被研究作为从实体肿瘤到炎症性疾病等多种疾病的治疗靶点。HPTMs在基因表达调控中的作用使它们成为治疗干预的有希望靶点,一些临床试验正在研究组蛋白乙酰化和组蛋白甲基化靶向疗法的使用[34]。如前所述,组蛋白乙酰转移酶(HATs)和HDACs参与赖氨酸残基的乙酰化[35],组蛋白甲基转移酶(HMTs)和组蛋白去甲基化酶(KDMs)参与组蛋白尾部的甲基化[35]。HDAC酶特异性调节染色质重塑(图2),分为四类:Class I通常位于细胞核,Class II在细胞核和细胞质之间穿梭,Class III主要位于线粒体但可在细胞核和细胞质中找到,Class IV存在于细胞核中[36]。HDAC和HAT药理抑制剂(HDACi和HATi)均已开发,但前者更广泛用作抗癌药物,并已被批准用于血液癌症如多发性骨髓瘤和复发或难治性外周T细胞淋巴瘤(PTCL)。由于BC和LC的大多数临床研究评估HDACi的疗效,我们将在以下两节中探讨这些化合物在临床前活性。关于PCa和肉瘤的最后两节还将探讨一些组蛋白甲基转移酶抑制剂(HMTi)的作用,因为该类在针对该恶性肿瘤的临床试验中更积极测试。
HDAC酶在雌激素和孕激素受体通路的转录调控中起作用。HDACis,如恩替诺特,已显示通过诱导细胞周期 arrest和凋亡在临床前ER阳性和三阴性BC模型(TNBC)中促进抗肿瘤活性[40]。恩替诺特是一种Class I HDAC抑制剂,促进特定基因的超乙酰化和转录激活,可抑制细胞增殖和凋亡[41]。与其他癌症一样,诊断为BC的患者的死亡率几乎总是由于该疾病的转移扩散。在TNBC模型中,恩替诺特治疗减少了肿瘤起始细胞(TICs)的群体,并导致减少的 mammosphere形成能力,以及减少的体内肿瘤形成。重要的是,恩替诺特治疗后癌细胞传播减少,这也导致减少的肺转移定植[42]。转移通常由EMT实现,这是TNBC的特征。体外,Shah及其同事证明恩替诺特治疗可逆转EMT,这可能减少转移的形成[43],在患者来源的异种移植(PDXs)中,恩替诺特与来曲唑或依西美坦联合显示更大的抗肿瘤活性,显著降低肿瘤生长速率,与单药治疗相比[44]。基于这些有希望的临床前结果,一些临床试验探索了恩替诺特在BC中的疗效,如第4节进一步讨论。
伏立诺他(辛二酰苯胺异羟肟酸-SAHA)是一种口服Classes I和II HDACs的HDACi,是第一个FDA批准的HDACi[44],并通过结合到酶催化结构域中的锌离子抑制HDACs的催化激活[45],并通过诱导自噬、细胞周期 arrest、抑制增殖和肿瘤生长减少在 luminal和TNBC BC模型中促进抗肿瘤活性[45]。有趣的是,据报道伏立诺他调节通常不在TNBC中表达的受体,导致雌激素受体α(ERα)和孕激素受体(PR)的重新表达,从而抑制TNBC细胞的生长及其对他莫昔芬的敏感化[46]。然而,在MCF-7细胞中,它们是ERα和PR阳性,伏立诺他可通过抑制ERα基因表达和刺激泛素-蛋白酶体途径降解在转录和翻译后蛋白水平上耗尽ERα,这可能作为激素难治性BC的新疗法[45]。
有人提出HDACis可发挥有效的抗转移活性,但少数研究表明HDACis可促进其他癌症的转移。在Hu等(2023)的一项研究中,体内单药治疗与伏立诺他导致BC细胞的形态变化,增加侵袭性并促进LC转移。这些结果突出了需要研究潜在联合疗法以提高HDACis在BC中的临床疗效,特别是因为单药治疗与HDACis(如伏立诺他)的有希望临床前结果尚未很好地转化为临床研究,产生负面结果。然而,研究伏立诺他与抗肿瘤药物联合疗效的临床前和临床研究显示了有希望的结果。例如,Mitchell等证明当伏立诺他与细胞周期蛋白依赖性激酶(CDK)抑制剂flavopiridol联合时,在BC细胞中具有协同致死性,Min等通过诱导DNA损伤和凋亡在TNBC细胞中鉴定出olaparib的敏感性增加。
与BC类似,临床前伏立诺他单药治疗和联合治疗已在小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)中广泛研究。临床前单药治疗与伏立诺他在NSCLC中对
 生物通微信公众号
生物通微信公众号
知名企业招聘