
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:雄激素受体及其蛋白相互作用组在去势抵抗性前列腺癌中不断演变的角色
【字体: 大 中 小 】 时间:2025年09月20日 来源:Oncogene 7.3
编辑推荐:
本综述系统阐述了雄激素受体(AR)在去势抵抗性前列腺癌(CRPC)中的核心驱动作用及其作用机制的演变。文章深入探讨了AR在转录调控(包括非编码RNA影响)、非转录功能(如剪接与翻译控制)等方面的最新进展,并强调了其庞大的蛋白相互作用组(interactome)在介导耐药性中的关键性。作者指出,靶向AR-共调节因子(coregulator)相互作用而非单纯雄激素剥夺,为克服CRPC治疗耐药提供了新的策略方向。
雄激素受体(AR)是一种配体激活的转录因子,是致命性前列腺癌(CaP)进展的主要驱动因素。雄激素剥夺疗法(ADT)通过阻止雄激素与AR结合,八十多年来一直是治疗非器官局限性CaP的基石。虽然ADT初期能诱导缓解,但最终会产生耐药,且绝大多数去势抵抗性前列腺癌(CRPCs)的生长仍依赖于AR的作用。ADT下复发的CaP其持续的AR依赖性,历来与AR的转录活性相关,该活性控制着一套独特的靶基因程序的表达,这些基因介导了侵袭性行为。近年来,AR非传统的转录作用(如影响非编码RNA)以及非转录依赖的作用(包括AR依赖的剪接程序和翻译控制)已被认识到对CaP的侵袭性特征和治疗耐药有所贡献。
尽管ADT药物不断进化,但获得性耐药仍不可避免地发生,导致美国每年超过35,000例CaP死亡。这种耐药主要源于AR信号轴的改变,使CaP细胞在ADT下仍能维持AR活性。例外是一小部分(少于20%)的致死性CaP,其经序贯强效ADT诱导后变为AR非依赖型,常被称为神经内分泌前列腺癌(NEPC)。
在ADT的压力下,CaP通过三个层面的调整来以AR依赖的方式进展:雄激素水平(如肿瘤内雄激素合成)、AR基因本身(如扩增、突变、产生剪接变体AR-Vs)以及AR转录所需的大量分子机制(即其蛋白相互作用组)。
AR与其他核受体家族成员共享模块化结构。其高度结构无序的N端域(NTD)包含一个反式激活功能(AF),即使在没有雄激素的情况下也具有组成性活性,且其在CaP进展过程中的作用变得更为关键。DNA结合域(DBD)与特定的DNA基序(通常称为雄激素反应元件,AREs)相互作用。通过一个短的铰链区,DBD与配体结合域(LBD)相连,雄激素配体和AR拮抗剂在此结合,且该域包含一个配体依赖的反式激活域。
当前观点认为,AR作为二聚体发挥作用,通过单体间的分子内和分子间接触(现在认识到涉及AR的大部分结构域:NTD、DBD和LBD)发挥作用。该模型意味着, upon androgen binding, AR被激活,失去与伴侣蛋白的相互作用,易位至细胞核,以二聚体形式结合到AREs上,并在庞大的调节蛋白相互作用组(interactome)的协助下激活或抑制其靶基因的转录。
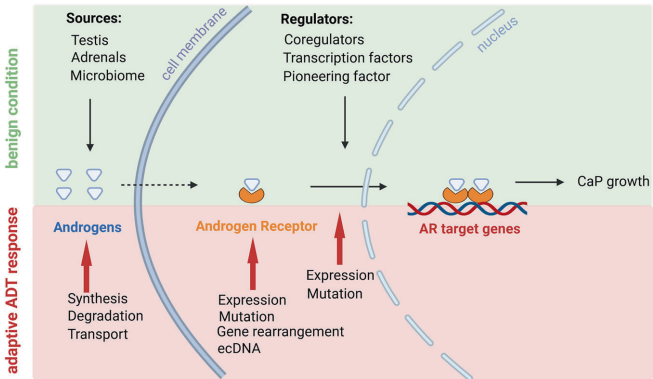
已报道的异质性大多与AR结合的AREs谱及其所招募的蛋白相互作用组(或染色质组)有关,以改变其靶基因的表达模式。
典型AREs由5'TGTTCT3'六聚体的重复组成,中间相隔三个碱基对,类似于其他核受体(如GR)的DNA识别基序。应用ChIP-Seq等技术已在CaP细胞系和组织中定义了全基因组范围的AR结合位点(ARBSs),确定了超过10,000个AR结合位点,大多数位于增强子和基因间区而非启动子区。
组学研究表明,ARE序列存在显著的简并性。异质性体现在教科书式的含两个六聚体的15 bp ARE序列内部的碱基错配数量、每个ARE的六聚体数量以及ARE中单个六聚体之间间隔区的构成上。序列简并性涉及每个15聚体ARE有1到3个碱基错配,非完美AREs中六聚体之间3 bp间隔区的GC含量更高,并且超过三分之二的AREs被认为仅由半个位点(half sites)组成,少数构成经典的15聚体AREs。目前认为至少99%的AREs是简并的,简并基序与转录结果负相关,而半位点更受通过相邻基序或协作因子作用的转录因子影响。
ARE共识组成的差异似乎也与CaP进展阶段相关。比较良性和局限性原发性CaP组织之间的基因组AR结合模式,在恶性组织中观察到显著转变,出现了新的“恶性”AR结合位点,而“良性”位点丢失了。大多数恶性AREs仅由半位点组成。对匹配AR结合峰的序列进行仔细检查发现,AR协作转录因子(如FOXA1和HOXB13)的结合位点在AREs附近富集。
在ADT初治的原发性CaP和CRPC之间观察到AR cistrome的又一次转变,ADT耐药后AR结合位点增加。这些改变可能是由CRPC进展过程中出现的AR表达和功能变化所介导的。例如,AR过表达(由AR基因扩增或增强子重复引起)会增加AR结合位点的数量并导致全基因组染色质松弛。类似地,ADT下由AR基因重排或选择性剪接产生的AR变体(ARVs)导致了一个新的AR cistrome,其与全长AR结合的cistrome至少部分重叠。
最近一篇论文关注于随着CaP进展而逐渐丢失的AR结合位点,即经典的15聚体AREs。研究表明,在CaP细胞中激活经典AREs会驱动介导分化和生长抑制的基因转录。由经典AREs驱动的转录促进了正常前列腺谱系分化,消除这种作用对CaP细胞可耐受,但对正常前列腺上皮细胞有害。由此产生的基因特征与改善的预后相关。这些发现表明,来自不同类型AREs的背景依赖性转录赋予了CaP细胞行为不同的侵袭性,进而暗示恢复经典AREs的转录可能提供治疗机会。
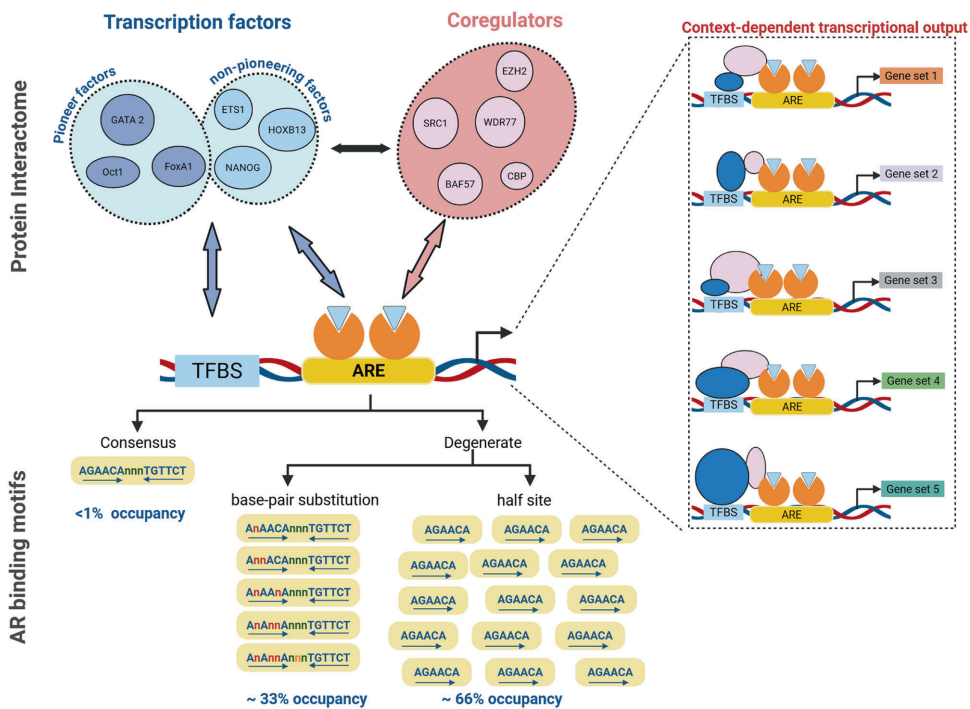
这些发现以及显示AR相关转录因子参与建立恶性AR cistrome并执行其对CaP细胞行为影响的发现,突出了AR相互作用蛋白在AREs控制基因的转录调控中的重要作用。已有数百种此类蛋白被报道。除了识别AREs附近结合位点的转录因子和非DNA相互作用的共调节因子(coregulators)外,这个相互作用组还包含先驱转录因子(pioneering transcription factors)(如FOXA、OCT和GATA家族成员),它们促进染色质可及性,使得AR能够结合AREs。
AR相关的共调节蛋白显示出显著的功能多样性,并以不同方式影响AR的转录作用。这包括促进染色质可及性(例如通过SWI-SNF蛋白)和有助于此过程的组蛋白修饰(例如由组蛋白乙酰化酶如p300和去乙酰化酶如HDAC3行使的功能)。另一方面,共调节因子HIP1代表了一类可能不太明显调节转录的蛋白,即内吞和细胞内蛋白转运体。还有其他蛋白,包括SUMO2和SUMO3,对AR及其相关染色质组进行翻译后修饰,控制AR转录复合物的组成和活性。
这些结果支持了共调节因子及其与其他AR招募蛋白的相互作用在塑造AR cistrome和介导其转录输出中的关键作用。这与先前关于共调节因子在AR靶基因上背景依赖性作用的报告一致,它们优先与AR转录复合物的其他组件相互作用以控制细胞生物学的各个方面和CaP进展的阶段。其他报告表明,单个AR相互作用的转录因子,如HOXB13,可以通过不同机制影响AR转录。
很明显,AR与其蛋白网络的相互作用,以及它所结合的ARE类型,可以显著影响DNA结合AR的转录输出,因此,并不存在一种放之四海而皆准的AR调控含ARE基因转录的机制。
上述机制见解与转录因子作用的变构调节一致,即其所结合的DNA基序类型及其蛋白和配体相互作用影响其构象可塑性,以及可调控的多聚化和蛋白质相互作用表面的可用性,从而控制背景依赖性和基因特异性的转录活性。基于过去十年的文献报道,变构调节作为AR活性的一种调节模式已变得越来越明显和被接受。
最近一项研究结合使用cryo-EM和质谱分析技术对结合了经典ARE的重组AR蛋白进行了研究。作者报告了DNA结合AR的三种 distinct states,并将其命名为entrenched, splayed and divorced architectures,这些构象反映了两个AR单体之间距离逐渐增加的状态。这种可塑性大部分源于2个LBD的定位,尽管DBD二聚化也允许AR二聚体发生构象变化。从entrenched到splayed再到divorced构象,2个LBD之间以及它们与DBD之间的距离各自增加。研究发现,LBDs之间的协同作用使得从较弱的、不完美的AREs进行反式激活成为可能,并注意到直接的AREs重复会增强但并非AR二聚化所必需。因此,AR二聚化利用了可调控的表面,这些表面对结构域间的变构非常重要,并且对于结合与最佳教科书序列偏差很大的AREs尤为重要,这解释了CaP中偏离理想序列的AREs如何仍能产生强大的转录输出。这些研究还表明,来自这个次优cistrome的AR靶基因表达受到AR相关转录因子ERG的强化。
高度无序的蛋白质或具有高度无序区域的蛋白质,如AR及其几个相互作用因子(包括MED1和SRC-3),经常在无膜分子凝聚体中进行液-液相分离。 several reports agree that AR存在于此类凝聚体中,这也符合长期观察到的 punctuate AR nuclear expression patterns,并且一些报告认为这对AR变体也是如此。然而,AR哪个结构域与此相分离最相关仍在争论中。这种细胞分布特征可能为干扰AR作用(包括在CRPC细胞中)提供替代策略。
这些新的见解支持了在AR对ARE驱动基因表达的控制中公认的日益增加的复杂性和背景依赖性,其大部分是通过与其精细多样的蛋白相互作用组的相互作用来执行的。这些相互作用对部分AR转录输出的选择性可能为破坏特定AR转录复合物组成的替代治疗策略提供重要的新机会。
在这方面,重要的是要考虑到目前所认识的影响AR靶基因转录的分子粒度可能仍然是被低估的。例如,AR最近被显示还介导AR靶基因的替代切割和多聚腺苷酸化(APA)。由此产生的转录组重编程是CaP细胞对ADT的适应性反应,它改变了调节APA的蛋白复合物的组成,从而改变了其活性。此外,几个研究组已经报道,AR控制着一系列选择性剪接事件,这独立于其在AR靶基因转录中的传统作用,使得AR能够进一步微调CaP细胞转录组。在另一种转录后机制中,AR和雄激素剥夺劫持了翻译机器来塑造细胞蛋白质组。这是通过AR对翻译抑制剂4EBP1的直接转录控制实现的,AR分别负向和正向调节该抑制剂(ADT正向调节)。
AR这些非传统的作用可能只是冰山一角,因为非编码RNA(ncRNAs)在AR作用中经常被低估的角色或受AR控制的事实也变得越来越明显。认识到蛋白编码基因的表达可能受非编码RNA影响,导致了竞争性内源RNA(ceRNA)框架的提出。最初,该模型中的非编码部分包括 microRNAs(miRNAs),这是一种小的(21-23核苷酸)单链非编码RNA分子,通过结合mRNA并阻止其翻译成蛋白质,在调节基因表达中起关键作用。ceRNAs通过竞争共享的miRNAs来调节其他RNA转录本。自其最初 formulation 以来,已经清楚ceRNA不仅涉及编码mRNA与miRNA,还可以扩展到miRNA与长链非编码RNA(lncRNAs)和环状RNA(circRNAs)的结合。
在CaP进展过程中会发生lncRNAs的表达失调。基因表达谱分析 efforts have shown that several lncRNAs are upregulated in CaP and during the development of treatment resistance. 它们表达的增加可以通过多种方式影响AR,包括通过RNA-RNA杂交稳定AR mRNA(ARLNC1)、吸收miRNAs(plncRNA-1)、促进mRNA剪接(PRKAG2-AS1, HOXC-As1)、干扰对AR靶基因的表观遗传控制(SOCS2-AS1)、阻止AR降解(HOTAIR)、调节其与染色质的结合(PCAT1)或通过与AR结合从而增强其反式激活活性(PCAT8, PCGEM1)。 fewer lncRNAs that influence AR function are downregulated in CaP. 这些包括,例如,GAS5(与AR结合并抑制其转录活性)和LBCS(与AR mRNA结合抑制其翻译)。
除了从差异lncRNA表达出发,还采用了多样化的、更全面的方法来定义与CaP进展相关的lncRNAs及其如何影响CaP行为。这些策略通常涉及挖掘或生成多组学数据,关注的终点包括lncRNA与CaP预后的相关性、lncRNA的分子功能或其生物学作用。
lncRNA表达本身可以是AR依赖的,这为AR提供了一种间接方式来影响编码或非编码转录本的表达,也包括那些不一定含有ARE的转录本。虽然lncRNAs不控制AREs的序列完整性,但像LINC00844这样的lncRNAs可以调节全局的AR与染色质的结合,从而调节AR调控基因的全局表达,尽管其对特定类型AREs的贡献或偏好尚未确定。值得注意的是,由于这些特征,LINC00844已被提议作为AR的共调节因子。
已知lncRNAs会影响AR蛋白相互作用组,这是AR转录作用异质性的另一个关键决定因素。例如,通过RNA-RNA相互作用,CaP中过表达的lncRNA PCLN16稳定了HIP1(一种AR相关共调节因子)的mRNA,导致其表达增加,并形成增强AR信号的正反馈环。另一个lncRNA,SChLAP1,在一些CaPs中过表达,并通过促进转移和侵袭来驱动侵袭性CaP行为。它至少部分是通过拮抗SWI/SNF复合物的肿瘤抑制功能来实现这一点的,该复合物的几个组分是AR共调节因子。雄激素应答lncRNA CTBP1-AS与CTBP1(AR的辅抑制因子)反义编码。CTBP1-AS在CaP中上调,并促进ADT初治和CRPC的生长。机制上,CTBP1-AS通过招募RNA结合转录抑制因子PSF以及组蛋白去乙酰化酶直接抑制CTBP1表达。
CircRNAs是通过反向剪接形成共价闭合连续环的单链RNA。虽然大多数是非编码的,但一些已被报道可编码蛋白质。关于circRNAs在CaP进展和AR功能中的数据相对较新,仍在积累中。采用了与用于确定lncRNAs的CaP相关性类似的方法。
与lncRNAs的发现一致,circRNAs在CaP进展过程中差异表达。在一项恩杂鲁胺耐药的同基因细胞系模型中,circRNA profiling 发现了超过800个circRNAs,其中大多数在耐药细胞系中下调。其中一个被抑制的circRNA,hsa_circ_0004870(其亲本基因是RBM39),在高表达AR的细胞和恶性细胞中也显示表达降低。这表明hsa_circ_0004870可能通过RBM39在恩杂鲁胺耐药的发展中起关键作用。剪接因子RBM39已被证明可控制AR前体mRNA中AR-V7剪接变体的选择性剪接并控制AR-V7的表达。
在另一项研究中,circZMIZ1在CaP患者血浆中的表达高于配对的良性前列腺增生(BPH)患者。circZMIZ1增加了AR和AR-V7的表达,而敲低circZMIZ1抑制了CaP细胞增殖并导致细胞周期停滞在G1期。另一个研究组在CaP细胞中鉴定了3000多个雄激素应答circRNAs,其中40%在转录水平上是AR依赖的。其余circRNAs的AR依赖性被认为是在转录后水平通过选择性剪接控制的。在一项全转录组分析中,hsa_circ_0085121(circRNF19A)在CaP细胞和样本中表现出过表达,并编码一个490个氨基酸的多肽,命名为circRNF19A-490aa。沉默circRNF19A抑制了CaP细胞的增殖、侵袭、迁移和多西他赛耐药。机制上,circRNF19A-490aa与HSP90AA1相互作用,从而增强AR活性并促进Akt/mTOR和PLK1信号通路的激活。circRNF19A-490aa还与HNRNPF相互作用,这促进了HNRNPF招募到AR-V7的剪接位点并增强了其选择性剪接。AR结合在RNF19A基因的启动子区域,调节circRNF19A和circRNF19A-490aa的表达。最后,通过分析来自CRPC样本的外显子捕获RNA-seq数据集以及对PDX和细胞模型进行的去核糖体化和RNase R RNA测序,分离出了由AR基因产生的circRNAs。这些AR circRNAs的表达在去势抵抗进展过程中上调,其水平与线性AR转录本的水平密切相关,表明存在转录水平的调节机制。这些circRNAs被雄激素和/或AR抑制。
配体激活的AR对CRPC进展的临床相关性及其作为治疗靶点的价值早已显而易见。绝大多数CRPCs持续的AR依赖性促使人们探索干扰其功能的其他方法。在这方面,我们的文献综述证实了AR转录因子部分的吸引力,并强调了其两个主要决定因素(其蛋白相互作用组及其DNA结合位点)对AR靶基因表达的背景依赖性转录调控的相关性。这种异质性可能提供治疗干预的机会。
最近的见解凸显了AR转录复合物额外的调控水平和更多样化的组成。例如,几种转录后机制诱导了AR靶基因转录本谱的额外变异性。其中几种本身受AR调控,表明存在先前未被认识的前馈和反馈机制。这种异质性可以通过AR对选择性剪接和翻译的控制来实现。最近,非编码RNA,如lncRNAs和circRNAs,也被认识到以多种方式影响AR的转录因子功能。这些效应主要在lncRNAs中有所描述,但也开始出现在circRNAs中。
如何调和这些新的贡献与对AR转录活性调控的现有认识?首先,需要更好地理解这些作用是直接的还是间接的。一些lncRNAs已被证明直接结合在AR靶基因的染色质上,但它们是否对特定类型的AREs有偏好尚不清楚,lncRNA结合的AR靶基因染色质环境的全谱也不清楚。lncRNAs或circRNAs在多大程度上是AR转录复合物的一部分,并与AR蛋白相互作用组相互作用,尚未被理解。如果以及如何ncRNAs影响AR复合物的变构调节需要解决。
未来的研究还需要更详细地检查特定CaP阶段和治疗对ncRNAs贡献于AR作用的影响。与共调节因子类似,相当一部分ncRNAs似乎是AR和ADT控制的,因此它们的作用可能受ADT或BAT(双极性雄激素疗法)的影响,或受ADT压力下发生的AR表达变化、AR基因重排或AR突变的影响。在这方面,CaP治疗可能会影响配体环境(ligand milieu)的组成,这可能进一步影响AR构象和作用,因为配体是核受体(NR)变构的第三个决定因素。
这些增加的复杂性以及需要克服的局限性可能被视为具有挑战性。但同时,它们可能提供新的策略,例如反义寡核苷酸(ASOs)(已获FDA批准用于治疗其他人类疾病)能够破坏转录复合物中的ncRNA相互作用。靶向lncRNAs PCAT6和LINC01126的ASOs已被证明能够减少CaP生长。防止AR相互作用组在部分AR靶基因上的正确组成可能克服对ADT的获得性耐药,并绕过导致NEPC出现的细胞可塑性。
 生物通微信公众号
生物通微信公众号
知名企业招聘