
-

生物通官微
陪你抓住生命科技
跳动的脉搏
ICAM-1介导的细胞互作增强星状细胞支持表型并驱动iPSC来源肝类器官中肝细胞增殖
【字体: 大 中 小 】 时间:2025年09月20日 来源:Stem Cell Reports 5.1
编辑推荐:
本研究针对肝星状细胞(HSCs)与肝细胞在人类肝脏再生中的相互作用机制不明确的问题,通过建立新型iPSC来源的肝星状细胞样细胞(iPS-HSCs)与肝细胞样细胞(iPS-Heps)直接接触共培养类器官模型(iHSOs),揭示了ICAM-1/IL-1β信号轴通过增强星状细胞支持表型促进肝细胞增殖的机制。该研究为人类肝脏再生机制研究提供了创新平台,对肝纤维化治疗策略开发具有重要科学意义。
在慢性肝脏疾病领域,肝纤维化是导致肝硬化和肝功能衰竭的关键病理过程,全球每年因肝硬化死亡人数占总死亡人数的2.4%。肝星状细胞(hepatic stellate cells, HSCs)作为产生细胞外基质的主要细胞类型,在肝纤维化发展中起着核心作用。在健康肝脏中,HSCs处于静息状态,储存维生素A;而当肝脏受损时,HSCs被激活转化为肌成纤维细胞,大量产生胶原等细胞外基质成分。然而,HSCs与肝细胞之间的相互作用机制,特别是直接细胞接触和细胞粘附分子的作用,在人类系统中仍不明确。
传统研究主要依赖动物模型,但由于物种差异,这些模型在模拟人类肝脏生理方面存在局限。近年来,人多能干细胞(induced pluripotent stem cell, iPSC)技术的发展为肝脏疾病研究提供了新工具。研究人员已成功从iPSC分化获得肝星状细胞样细胞(iPS-HSCs)和肝细胞样细胞(iPS-Heps),但这些细胞在传统二维培养中容易自发激活,失去静息特征,且未能完全模拟体内HSCs的表型多样性。
为了解决这些问题,东京医科齿科大学的研究团队开发了一种新型三维共培养系统——iPSC来源的肝细胞-星状细胞环绕类器官(iHSOs)。这一模型独特之处在于iPS-HSCs自发地环绕在iPS-Heps形成的核心结构周围,形成了与体内肝脏组织相似的空间结构。
研究采用iPSC定向分化技术获得iPS-HSCs和iPS-Heps,通过荧光标记细胞共培养形成三维类器官,结合RNA测序(包括bulk RNA-seq和scRNA-seq)、免疫荧光染色、电子显微镜、EdU增殖检测和ICAM-1功能抑制实验等技术手段,系统分析了细胞间相互作用机制。

Partial inhibition of myofibroblastic change in iPS-HSCs
研究人员首先将人iPSC分化为iPS-HSCs,这些细胞表达HSC相关标志物(NGFR、CYGB、ALCAM、RGS5)以及DESMIN和VIMENTIN。在二维单层培养中,iPS-HSCs会自发激活,表现为静息标志物下调而激活标志物(ACTA2、COL1A1)上调。而在三维培养中,iPS-HSCs的激活受到部分抑制,NGFR表达维持,LRAT表达增加,ACTA2表达降低,维生素A储存增加,表明三维环境有助于维持HSCs的静息状态。
Establishment of new organoids using both iPS-HSCs and iPSC-derived hepatocyte-like cells
研究团队建立了iPS-HSCs与iPS-Heps的直接接触共培养系统。iPS-Heps高表达肝细胞标志物(HNF4A、AFP、ALB、CYP3A4)。共培养3天后形成类器官,iPS-HSCs自发地环绕在iPS-Heps周围,形成独特的"环绕"结构(iHSOs)。这种结构在不同iPSC系中均能重复产生。电子显微镜分析显示,iPS-HSCs具有多个细长突起,与内部肝细胞建立接触,且能够储存维生素A。

iPS-HSCs promote the proliferation of iPS-Heps within iHSOs
共培养7天后,iHSOs中的肝细胞区域直径和面积均显著大于肝细胞单独培养的类器官。EdU掺入实验证实iHSOs中肝细胞增殖率显著提高,且这种促进作用依赖于足够数量的HSCs,表明HSCs通过细胞间相互作用刺激肝细胞增殖。
Induction of quiescent and early activation states in iPS-HSCs by hepatocyte-stellate cell interaction
RNA-seq分析显示,iHSOs中的iPS-HSCs转录组特征明显不同于单培养的iPS-HSCs。基因集富集分析表明,iHSOs中的iPS-HSCs富集于静息和早期激活状态的HSC标志物,表现为NGFR、LRAT、CYGB、HGF、CXCL1和CCL2等基因上调,而ACTA2和TIMP1表达无显著变化。这种表型特征与最近单细胞研究中定义的"cyHSC"(细胞因子富集型HSC)或"initiatory HSC"(起始型HSC)亚群相似。
Unique characteristics of iPS-HSCs within iHSOs
与其它干细胞来源的HSC相比,iHSOs中的iPS-HSCs独特地富集于静息HSC相关特征和cyHSC特征,而传统激活的HSC特征富集程度较低,表明iHSO系统成功诱导了具有生理相关性的HSC表型。
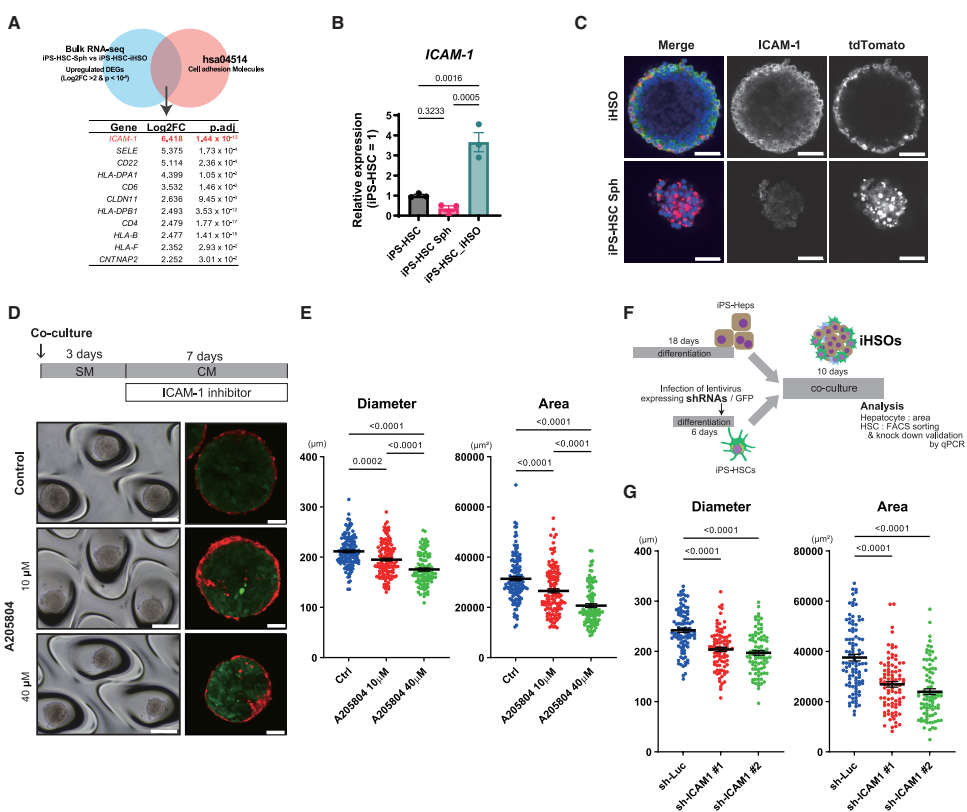
ICAM-1 in HSCs mediates cellular interactions within the iHSOs
研究发现细胞粘附分子ICAM-1在iHSOs中的iPS-HSCs表达显著上调。免疫染色显示ICAM-1表达在类器官外围的iPS-HSCs上。使用ICAM-1抑制剂(A205804、A286982)或shRNA敲低ICAM-1表达均导致iHSOs中肝细胞区域减小,表明ICAM-1在HSC-肝细胞相互作用中起关键作用。
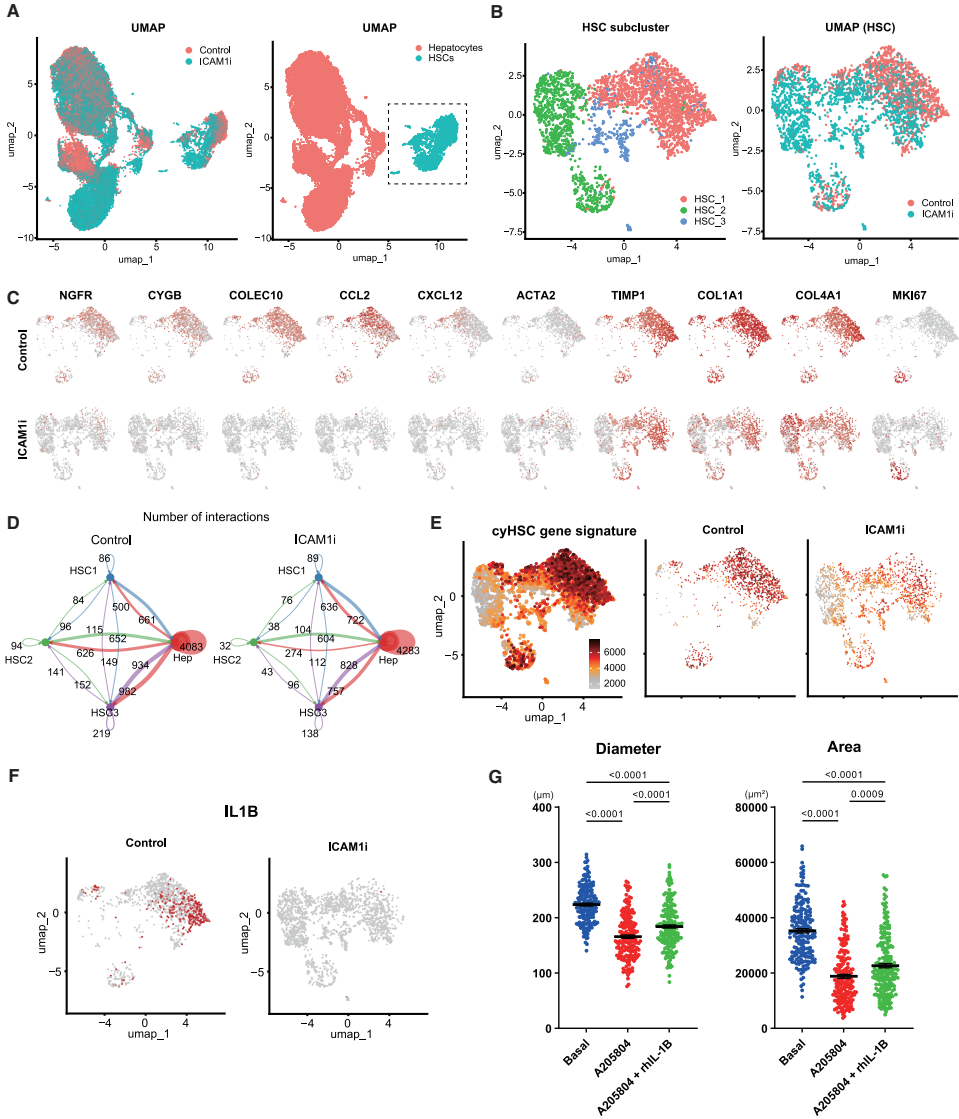
ICAM-1-driven IL-1β crosstalk promotes hepatocyte growth in iHSOs
单细胞RNA测序分析发现,iHSOs中的HSCs可分为三个亚群:细胞因子富集型HSC(HSC_1)、增殖型HSC(HSC_2)和标志物低表达型HSC(HSC_3)。ICAM-1抑制处理后,肝细胞与HSC亚群间的相互作用减少,cyHSC特征富集度下降,IL-1β表达降低。添加IL-1β可部分逆转ICAM-1抑制导致的生长抑制,而IL-1β抑制剂则抑制iHSOs生长,表明ICAM-1通过调控IL-1β表达促进肝细胞增殖。
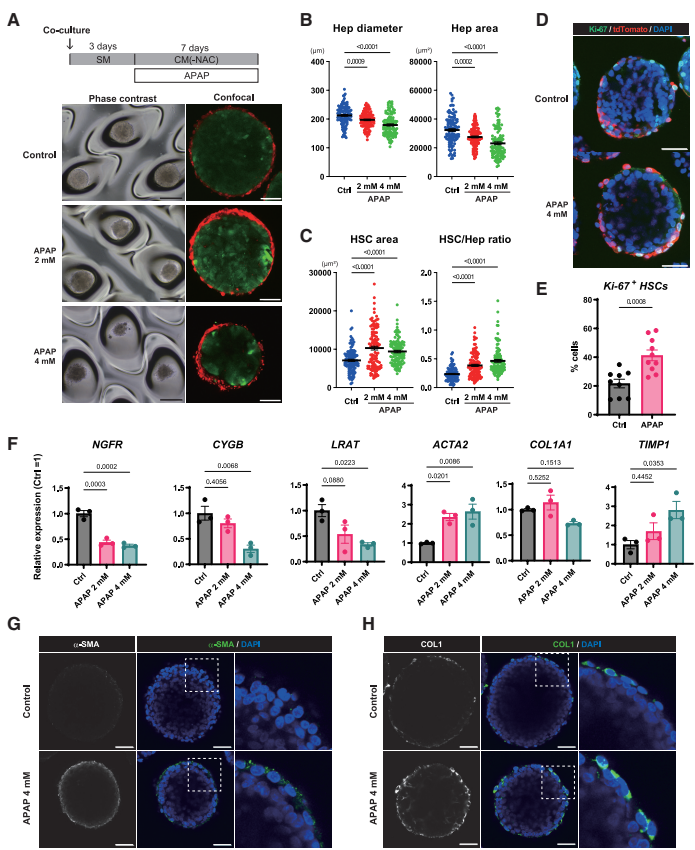
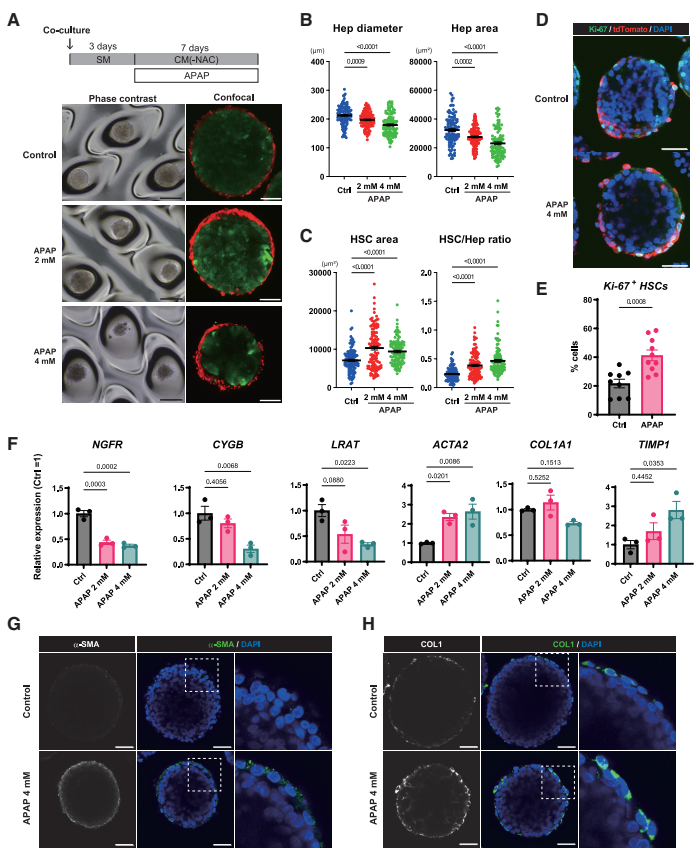
Acetaminophen-induced HSC activation model using iHSOs
研究还证明iHSOs可作为肝损伤和HSC激活模型。对乙酰氨基酚(APAP)处理后,肝细胞区域减小而HSC区域和HSC/肝细胞比率增加,HSC增殖(Ki-67阳性率)增强。静息标志物(NGFR、LRAT、CYGB)表达下降,而激活标志物(ACTA2、TIMP1)表达上调,胶原蛋白沉积增加,表明APAP诱导了HSC激活。
本研究建立的iHSO系统成功模拟了人类肝脏中HSC与肝细胞的相互作用,发现ICAM-1/IL-1β信号轴在介导细胞间通讯中的关键作用。iHSOs中的iPS-HSCs表现出独特的静息和早期激活表型(cyHSC/initiatory HSC),与体内发现的HSC亚群相似,而不同于传统干细胞分化的HSC。这一模型不仅为研究人类肝脏再生机制提供了宝贵平台,也为肝纤维化治疗策略的开发提供了新思路。
研究的创新点在于首次在iPSC来源的细胞中重现了HSC的表型多样性,并揭示了ICAM-1在HSC-肝细胞相互作用中的新功能。虽然iPSC来源的细胞仍存在胎肝细胞特征、与成人原代细胞存在发育阶段不匹配等局限,但iHSO系统允许对HSC和肝细胞进行双重遗传操作,为肝脏疾病机制研究和药物筛选提供了有力工具。
该研究成果发表于《Stem Cell Reports》期刊,为靶向HSC-肝细胞相互作用的抗纤维化治疗策略开发提供了重要科学依据,对推动肝脏再生医学发展具有重要意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘