
-

生物通官微
陪你抓住生命科技
跳动的脉搏
AAV9介导中枢神经系统靶向基因治疗中细胞特异性启动子的比较分析与新型GFAP截短启动子gfa1405的开发
【字体: 大 中 小 】 时间:2025年09月20日 来源:Molecular Therapy Methods & Clinical Development 4.7
编辑推荐:
本研究针对AAV9介导的中枢神经系统基因治疗中启动子选择的关键问题,系统评估了多种泛在性和细胞特异性启动子的生物分布、细胞特异性和外周靶向特性。研究人员开发了新型星形胶质细胞特异性截短启动子gfa1405,在保持特异性的同时减小了尺寸,为装载大转基因提供了优化方案。研究发现gfa1405在中枢神经系统的表达范围优于gfaABC(1)D,p546启动子有效靶向神经元,而少突胶质细胞特异性启动子呈现不同表达模式。该研究为AAV9基因治疗提供了启动子选择框架,通过最小化脱靶效应推进神经系统疾病治疗策略。
神经系统疾病是全球致残和死亡的主要原因之一,其中罕见神经发育障碍主要影响儿童,通常由单基因遗传突变引起。基因治疗作为解决遗传缺陷的有效手段,腺相关病毒(AAV)因其 favourable 特性成为主要病毒递送载体,其中AAV9血清型以高效中枢神经系统转导和血脑屏障穿透能力著称。然而,AAV载体有限的4.7-4.8 kb包装容量与启动子尺寸之间存在矛盾:泛在性启动子如CAG(CMV增强子/鸡β-肌动蛋白杂交启动子)虽然驱动广泛表达,但缺乏细胞特异性;而细胞特异性启动子虽能提高靶向精度,但往往尺寸较大,限制了治疗性转基因的装载空间。
为解决这一关键问题,研究团队开展了AAV9介导中枢神经系统靶向治疗中启动子的系统性比较分析,开发了新型截短启动子并评估其在不同神经细胞类型中的表达特性。研究旨在建立启动子选择框架,实现可变中枢神经系统细胞类型靶向,优化治疗效能,最终为神经疾病治疗提供实用工具集。
研究采用的主要技术方法包括:通过合理设计构建多种启动子驱动的EGFP表达载体并包装成ssAAV9病毒;通过新生小鼠(P0-P1)侧脑室注射方式递送载体;利用RT-qPCR、Western blot和免疫组化等多技术平台评估不同组织中的转录本和蛋白表达;采用激光共聚焦显微镜进行细胞类型共定位分析。所有动物实验均经机构动物护理和使用委员会批准。
研究结果通过多个维度展开:
Design and development of novel astrocyte-specific promoter derived from GFAP
基于GFAP启动子的特性,研究团队开发了新型截短版本gfaABCD1405(简称gfa1405)。通过保留内源性启动子的关键调控区域(C3、C5和C6),同时故意排除抑制性C2区域,成功构建了1,405 bp的启动子,比全长GFAP启动子节省803 bp空间,允许装载更大尺寸的转基因,同时保持强大的神经轴索靶向和星形胶质细胞特异性。
Examination of promoter-driven EGFP mRNA expression and protein distribution
通过RT-qPCR和蛋白表达分析,研究发现泛在性启动子CAG在CNS和外周组织中均显示最高EGFP表达,而细胞特异性启动子表现出不同的表达模式。新型gfa1405启动子驱动强大的EGFP mRNA表达,与全长GFAP启动子相当,甚至在某些CNS区域超过CAG和p546。p546启动子有效靶向神经元,在新皮层和海马体显示强烈表达。少突胶质细胞特异性启动子中,CNP启动子显示更广泛的转导,而MAG启动子主要在胼胝体驱动表达。

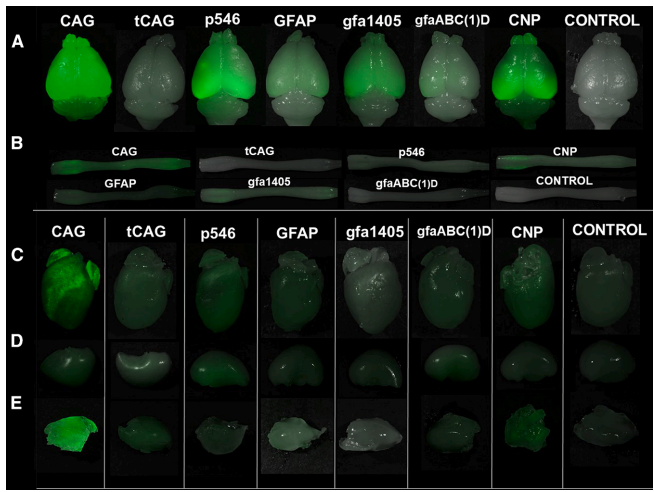
Comparative fluorescent analysis of EGFP protein expression and distribution
荧光分布分析显示,CAG启动子覆盖高达42%的脑总面积,而tCAG仅覆盖5.8%。p546启动子显示41%的分布面积,但表达模式与CAG不同。gfa1405启动子显示最广泛的EGFP分布,覆盖35%的脑区域,而全长GFAP覆盖约24%。少突胶质细胞启动子中,CNP覆盖37%的脑区域,而MAG仅覆盖5.5%。
**

Colocalization analysis of EGFP protein expression with cell-specific biomarkers
细胞共定位分析证实了各启动子的细胞特异性:CAG与S100B(星形胶质细胞标记)和NeuN(神经元标记)均显示共定位;p546主要与NeuN共定位(72%);GFAP、gfaABC(1)D和gfa1405主要与S100B共定位(分别为44%、58%和37.7%)。少突胶质细胞启动子中,CNP显示16%的少突胶质细胞和21-29%的神经元共定位,而MAG显示65%的少突胶质细胞和仅13.5%的神经元共定位。
研究

研究结论表明,启动子选择在基因治疗载体设计中至关重要。新型gfa1405启动子成功平衡了效率与尺寸限制,提供比全长GFAP启动子更广泛的分布,同时节省了AAV载体空间,可用于更大的治疗基因。p546启动子表现出强大的神经元特异性靶向能力,而CNP启动子能够靶向少突胶质细胞和神经元,展示了解决复杂神经退行性疾病所需的多样性。
该研究的重要意义在于提供了全面的启动子比较分析框架,为CNS定向基因治疗提供了实用工具集。通过最小化脱靶效应和优化细胞特异性表达,这些启动子有望提高基因治疗的安全性和有效性。特别是gfa1405和p546等截短启动子展示了在保持细胞特异性的同时减小尺寸的可行性,为装载大尺寸治疗性转基因提供了解决方案。研究还强调了启动子工程和优化对于治疗应用的必要性,特别是在比较泛在性启动子与细胞特异性选项时。
这些发现为开发高度专业化的下一代载体铺平了道路,这些载体可以安全有效地将治疗基因递送到CNS中的特定细胞类型。通过继续探索和优化细胞特异性启动子,可以加速靶向基因治疗的发展,这些治疗有潜力彻底改变各种神经系统疾病的治疗方法。
论文发表于《Molecular Therapy Methods 》期刊,为基因治疗领域提供了重要的工具资源和理论指导,特别是在启动子选择和优化方面提供了系统性的实验证据和实用方案。
 生物通微信公众号
生物通微信公众号
知名企业招聘