
-

生物通官微
陪你抓住生命科技
跳动的脉搏
奥贝胆酸通过调控SIRT1与TLR4/NF-κB通路预防环磷酰胺诱导的胎盘损伤
【字体: 大 中 小 】 时间:2025年09月21日 来源:BMC Pharmacology and Toxicology 2.8
编辑推荐:
本刊推荐:为解决环磷酰胺(CP)化疗药物诱发胎盘损伤的临床难题,研究人员开展奥贝胆酸(OCA)干预研究,发现OCA通过激活SIRT1/Nrf2通路并抑制TLR4/Myd88/NF-κB通路,显著改善胎盘氧化应激(MDA↑、TAC↓)、炎症(TNF-α、NF-κB↓)及凋亡(caspase-3↓)指标,并逆转胎盘组织病理损伤,为化疗致胎盘毒性的防护提供新策略。
在妊娠过程中,胎盘作为胎儿与母体之间的关键连接器官,承担着呼吸、营养输送、排泄及内分泌调节等重要功能。然而,化疗药物环磷酰胺(cyclophosphamide, CP)在治疗自身免疫性疾病(如系统性红斑狼疮)和恶性肿瘤时,虽对母体疾病控制具有显著效果,却因其非选择性细胞毒性作用,可穿透胎盘屏障引发胎儿及胎盘损伤,导致妊娠并发症风险显著增加。目前临床上缺乏针对CP诱导胎盘毒性的有效防护手段,因此探索其分子机制并寻找干预靶点成为当务之急。
在此背景下,Walaa Yehia Abdelzaher等研究人员在《BMC Pharmacology and Toxicology》发表论文,探讨了法尼醇X受体(farnesoid X receptor, FXR)激动剂奥贝胆酸(obeticholic acid, OCA)在CP诱导胎盘损伤中的保护作用及机制。
研究团队通过建立孕大鼠CP损伤模型,从胎盘重量、胎盘生长因子(placental growth factor, PlGF)、氧化应激参数(丙二醛malondialdehyde, MDA、总抗氧化能力total antioxidant capacity, TAC)、炎症与凋亡标志物(Sirtuin type 1, SIRT1;核因子E2相关因子2, nuclear factor erythroid 2-related factor 2, Nrf2;髓样分化因子88, myeloid differentiation factor 88, Myd88; caspase-3)、基因表达(肿瘤坏死因子-α, tumor necrosis factor-α, TNF-α;核因子κB, nuclear factor-kappa B, NF-κB)及组织病理与免疫组化(Toll样受体4, toll-like receptor 4, TLR4;叉头盒转录因子1, forkhead-box transcription factor 1, FOXO1)等多维度展开系统评估。
关键技术方法包括:将32只孕鼠随机分为4组(对照组、OCA单独处理组、CP模型组、OCA+CP干预组),通过口服OCA(10 mg/kg/天)及孕12天单次腹腔注射CP(20 mg/kg)进行干预;于孕19天采集胎盘组织,采用ELISA检测氧化应激、炎症与凋亡蛋白指标,RT-qPCR分析基因表达,H&E染色与免疫组化评价组织病理变化与蛋白定位。
研究结果如下:
Effect of OCA on placental weight(wt) and PIGF in CP-induced placental toxicity
CP处理显著降低胎盘重量与PlGF水平(P<0.05),而OCA干预后两者均显著回升,表明OCA有效改善胎盘发育功能。

Effect of OCA on placental oxidative stress parameters in CP-induced placental toxicity
CP组胎盘MDA显著升高、TAC显著降低(P<0.05),OCA联合处理使两者趋于正常,提示OCA通过增强抗氧化能力缓解氧化损伤。
Effect of OCA on placental anti-inflammatory and anti-apoptotic parameters in CP-induced placental toxicity
CP显著抑制SIRT1与Nrf2表达,升高Myd88、caspase-3、NF-κB与TNF-α水平(P<0.05);OCA干预逆转上述变化,证实其抗炎与抗凋亡作用依赖于SIRT1/Nrf2通路激活与TLR4/Myd88/NF-κB通路抑制。


Histological results
CP组胎盘组织呈现绒毛结构破坏、合体细胞结节形成、间质水肿及含铁血黄素沉积,而OCA处理组胎盘形态接近正常,仅见少量含铁血黄素沉积。

Immunohistochemistry expression of TLR4 and FOXO1
CP组TLR4与FOXO1免疫表达显著增强(评分3分),OCA干预后表达强度显著降低(接近阴性),进一步验证OCA对TLR4/FOXO1信号通路的抑制作用。
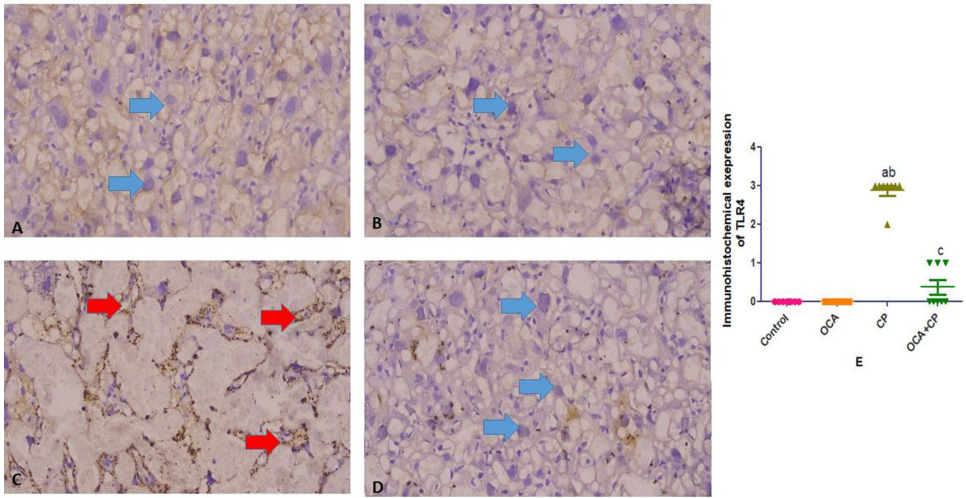

结论与讨论部分指出,OCA通过多通路交叉调控发挥胎盘保护作用:一方面激活SIRT1,进而增强Nrf2转录活性、抑制FOXO1介导的细胞凋亡,提升抗氧化能力;另一方面抑制TLR4/Myd88/NF-κB信号转导,减少TNF-α等炎性因子释放。该研究不仅阐明CP致胎盘毒性的分子机制(SIRT1下调、TLR4/NF-κB过度激活),还为OCA作为化疗辅助防护药物提供了临床前证据,尤其对需接受CP治疗的妊娠期自身免疫病患者具有重要转化意义。

 生物通微信公众号
生物通微信公众号
知名企业招聘