
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CB1R在迷走神经传入神经元特定亚群中调控小鼠自愿乙醇摄入的作用机制 中文标题:迷走神经Gpr65+神经元CB1受体调控乙醇摄入的机制研究及其治疗酒精使用障碍的潜力
【字体: 大 中 小 】 时间:2025年09月22日 来源:Molecular Psychiatry 10.1
编辑推荐:
本研究针对酒精使用障碍(AUD)治疗靶点不足的问题,通过转基因小鼠模型和药理学手段,揭示了外周 cannabinoid receptor 1(CB1R)在迷走神经结节状节(NGA)Gpr65+神经元亚群中对自愿乙醇摄入(VEI)的关键调控作用。研究发现,选择性敲除该亚群的CB1R或使用外周限制性CB1R拮抗剂JD5037和MRI-1891可显著抑制乙醇摄入,且该效应依赖于ghrelin受体(Ghsr)的共存表达。这一发现为开发非中枢神经系统的AUD治疗策略提供了重要理论依据和临床转化前景。
酒精使用障碍(AUD)是一种全球性健康问题,其特征是对酒精的强迫性消费和失控,尽管存在负面后果。现有治疗方法效果有限,仅对部分个体有效,因此迫切需要新的治疗策略。近年来,内源性大麻素系统(ECS)尤其是大麻素受体1(CB1R)在调节药物奖励和成瘾行为中的作用受到广泛关注。以往研究主要集中于中枢神经系统中的CB1R,尤其是腹侧被盖区、伏隔核和前额叶皮层等脑区,这些区域的CB1R激活会增强乙醇摄入和奖励效应。然而,越来越多的证据表明,外周CB1R同样在调节乙醇偏好中发挥重要作用。例如,无论是脑渗透性CB1R拮抗剂rimonabant还是非脑渗透性拮抗剂JD5037,全身给药均可抑制乙醇摄入,而脑室内给药则无效,提示外周CB1R的关键作用。
此外,肠-脑轴作为调节乙醇摄入的潜在途径也备受关注,其中胃饥饿素(ghrelin)等肽类物质尤为重要。胃饥饿素受体(Ghsr)拮抗剂可抑制乙醇消耗及其奖励特性。最近研究发现,内源性大麻素(ECs)通过CB1R促进胃饥饿素酰化,以迷走神经依赖的方式增加酒精摄入。这些发现强调了外周CB1R、Ghsr和肠-脑轴在酒精摄入中的重要作用,凸显了它们作为AUD治疗靶点的潜力。
尽管目前单细胞RNA测序数据和组织学研究已证实迷走神经和脊髓传入神经的外周感觉神经末梢存在不同亚群,各具特定遗传标记和功能,且结节状节(NGA)和背根节(DRG)中存在CB1R阳性和/或Ghsr阳性神经元,但究竟哪些感觉传入神经元亚群参与CB1R介导的VEI调控仍不清楚。为此,研究人员利用转基因小鼠模型,结合药理学和行为学实验,深入探究了CB1R在肠-脑轴不同神经元亚群中对VEI的调控机制。
本研究发表于《Molecular Psychiatry》,为了深入探索上述问题,研究人员运用了多种关键技术方法。研究使用转基因小鼠模型,包括组织特异性敲除CB1R或Ghsr的小鼠(如GhrlCre;Cnr1lox/lox、Phox2bCre;Cnr1lox/lox、Gpr65iresCre;Cnr1lox/lox等),通过PCR和RNAscope荧光原位杂交(FISH)进行基因型和表达验证。行为学实验采用两瓶选择测试(two-bottle choice test)和暗饮范式(drinking in the dark paradigm),评估乙醇摄入量。药理学干预使用外周限制性CB1R拮抗剂JD5037和MRI-1891(包括其S和R对映体),以及Ghsr拮抗剂PF-5190457,通过口服灌胃给药。分子生物学技术包括定量实时PCR(qRT-PCR)检测基因表达,液相色谱-串联质谱(LC-MS/MS)测量内源性大麻素水平,酶联免疫吸附测定(ELISA)检测血浆ghrelin浓度。此外,还通过皂草素(saporin)偶联CB1R抗体进行结节状节神经元选择性消融,以及他莫昔芬诱导的Cre重组酶系统实现特异性基因敲除。所有动物实验均遵循美国政府法规和国立卫生研究院(NIH)动物护理和使用委员会(IACUC)的伦理指南。
研究人员首先通过在ghrelin产生细胞中特异性敲除CB1R,发现虽然CB1R的缺失降低了基线乙醇摄入量,并削弱了JD5037的抑制效应,但JD5037仍能部分抑制VEI,表明除了ghrelin产生细胞外,其他外周细胞类型的CB1R也参与调控乙醇摄入。

通过他莫昔芬诱导性敲除advillin(Avil)表达的感觉神经元中的CB1R,研究人员发现基线乙醇摄入显著降低,且JD5037的抑制效应被消除,表明advillin+感觉神经元在调控乙醇摄入中起独特作用。相反,在Trpv1表达神经元中敲除CB1R并未影响JD5037的效应,提示Trpv1+感觉传入神经不参与小鼠VEI的调控。

特异性敲除NGA神经元(Phox2b+)中的CB1R可消除JD5037的抑制效应,而敲除DRG神经元(Wnt1+)中的CB1R则无此效果,进一步证实了迷走神经传入神经在CB1R介导的VEI调控中的关键作用。
通过皂草素偶联CB1R抗体选择性消融NGA中CB1R表达神经元,研究人员发现JD5037的抑制效应被削弱,这与迷走神经去传入程度一致,证实了CB1R+ NGA迷走神经传入纤维在调节小鼠VEI中的作用。
使用另一种外周限制性CB1R拮抗剂/反向激动剂MRI-1891,研究人员发现其S对映体可剂量依赖性地抑制野生型小鼠的酒精消耗,而R对映体无此效应,且在Cnr1-/-小鼠中无效。这一效应在Phox2bCre;Cnr1lox/lox和AvilCreERT2;Cnr1lox/lox小鼠中被消除,表明感觉传入神经元上的CB1R是不同CB1R拮抗剂抑制VEI的共同靶点。

在雌性小鼠中,JD5037和MRI-1891同样可通过CB1R+ NGA迷走神经传入纤维调控VEI,表明该机制在两性中均存在。
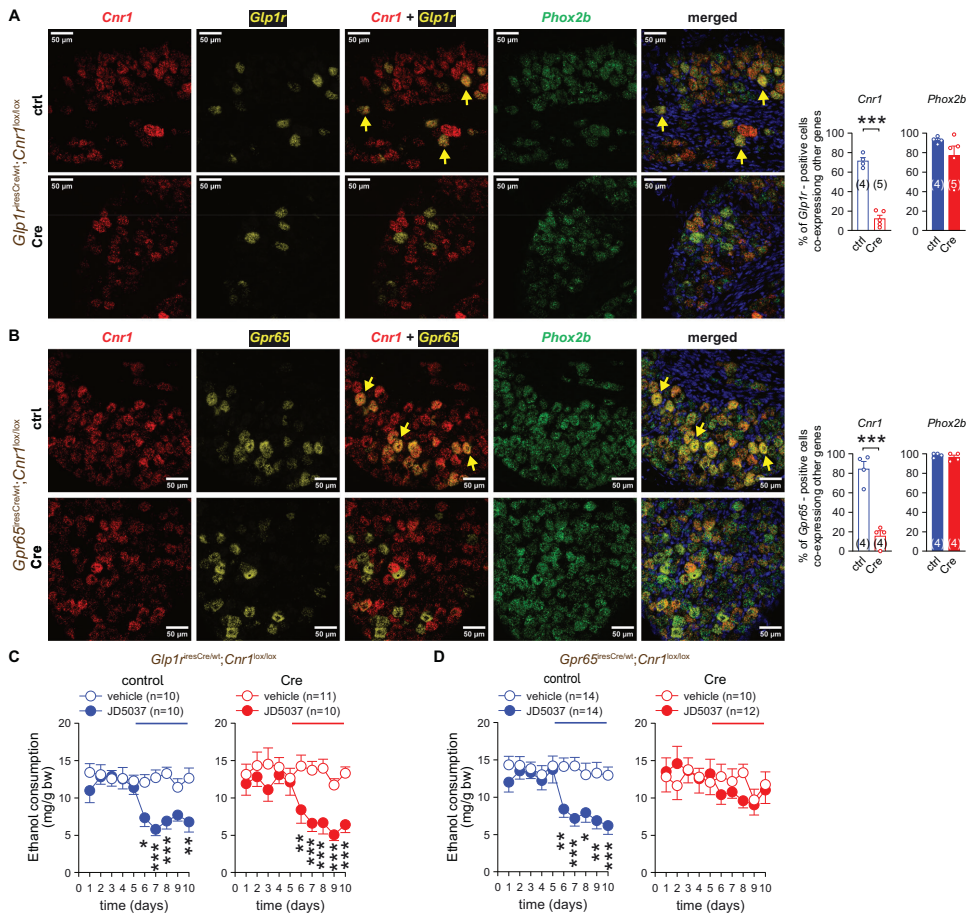
研究人员发现,敲除黏膜层Gpr65+迷走神经传入神经中的CB1R可消除JD5037的抑制效应,而敲除肌肉层Glp1r+传入神经中的CB1R则无影响,表明Gpr65+ NGA神经元是JD5037抑制VEI的关键靶点。

在Phox2b+ NGA神经元中特异性敲除Ghsr可降低基线VEI,并消除Ghsr拮抗剂PF-5190457和CB1R拮抗剂JD5037的抑制效应。相反,在Phox2bCre;Cnr1lox/lox小鼠中,PF-5190457的效应也被消除,表明CB1R和Ghsr在调控VEI中存在相互依赖关系。

酒精暴露并未改变NGA中Cnr1表达或内源性大麻素水平,但增加了NGA中油酰乙醇胺(OEA)的水平,且药物处理对食物摄入无显著影响,表明CB1R拮抗剂的效应特异性针对乙醇摄入。
本研究通过多维度实验证实,外周CB1R在迷走神经传入神经元特定亚群(尤其是Gpr65+和advillin+神经元)中扮演调控乙醇摄入的关键角色。这些神经元投射至胃肠道黏膜层,直接接触酒精后可能触发内源性大麻素产生,通过激活CB1R向中枢神经系统传递信号,促进酒精饮用行为。外周CB1R拮抗剂则通过阻断这一正反馈环路减少乙醇摄入。
此外,研究发现CB1R与Ghsr在NGA神经元中存在功能交互,两者共同调控VEI。这一发现不仅深化了对肠-脑轴在酒精奖励中作用的理解,也为开发非中枢神经系统的AUD治疗策略提供了坚实理论基础。特别是外周限制性CB1R拮抗剂MRI-1891(又名INV-202或monlunabant)已在代谢综合征患者中展现出抗肥胖疗效,目前正进行二期临床试验。本研究的发现强烈支持将该药物用于AUD治疗的临床测试。
总之,这项研究不仅揭示了外周CB1R新的作用机制,还提出了针对特定迷走神经神经元亚群的精准治疗策略,为酒精使用障碍的药物开发开辟了新的道路。
 生物通微信公众号
生物通微信公众号
知名企业招聘