
-

生物通官微
陪你抓住生命科技
跳动的脉搏
SN38前药纳米组装体表面工程的“双重性格”:体外与体内行为的背道而驰及其对肿瘤治疗的深远意义
【字体: 大 中 小 】 时间:2025年09月23日 来源:Military Medical Research 22.9
编辑推荐:
为解决SN38水溶性差、体内转化效率低及严重肠道毒性等问题,研究人员系统开展了不同PEG化水平(WDSPE-mPEG2k/Wprodrug; 0%-200%)对SN38前药纳米组装体(NPs)性能影响的研究。发现高PEG化(150% NPs)可显著改善药代动力学、延长循环时间、增强肿瘤蓄积并实现最佳抗肿瘤效果,且不引发加速血液清除(ABC)效应,为纳米药物表面工程提供了重要设计策略。
在肿瘤化疗领域,伊立替康(CPT-11)是治疗结直肠癌和胰腺癌的常用药物,但其疗效受到一个关键瓶颈的限制:它需要在体内转化为活性代谢物7-乙基-10-羟基喜树碱(SN38)才能发挥作用。然而,这种转化效率极低,仅在0.1%到1%之间,并且存在显著的个体差异。更棘手的是,肿瘤组织往往缺乏负责该转化的羧酸酯酶,转化主要发生在肝脏。在肝脏中,生成的SN38又会被尿苷二磷酸-葡萄糖醛酸转移酶1A1(UGT1A1)代谢为无活性的SN38-葡萄糖醛酸苷(SN38G),随后通过胆汁排泄进入肠道。肠道中的细菌β-葡萄糖醛酸苷酶能将SN38G重新转化为SN38,这导致了严重的剂量限制性肠道毒性,如重度腹泻。因此,直接递送SN38本身成为一个极具吸引力的策略,但SN38的水溶性和在常见有机溶剂中的溶解性极差,为其制剂开发带来了巨大挑战。
为了攻克这一难题,合理的前药设计应运而生。与需要复杂制备工艺的主动靶向抗体药物偶联物(ADCs,如Sacituzumab govitecan)相比,被动靶向的纳米递送系统因其制备相对简单而备受青睐,并有药物获FDA批准。通过将两个SN38药物分子用特定的化学 linker(连接子)连接起来,可以构建出二聚体前药,这种前药既能作为载体,也能作为载荷,具备自组装能力和超高的载药量。先前的研究筛选了一系列具有不同 linker 长度(C5至C18)的SN38二聚体前药,发现C12桥连的前药在自组装稳定性和活化效率之间取得了最佳平衡,展现出最好的抗肿瘤效果。然而,其药代动力学性质仍不理想,表明仅优化前药化学结构不足以实现高效的SN38递送。
纳米制剂的表面工程为克服这些挑战提供了充满希望的策略。通过修饰纳米颗粒的表面,可以使其逃避体内单核吞噬细胞系统(MPS)的识别和清除。其中,聚乙二醇化(PEGylation)已成为延长纳米制剂循环时间和增强肿瘤蓄积的关键手段。PEG能在纳米颗粒表面形成亲水层,防止疏水分子在水相环境中聚集沉淀,并减少蛋白质吸附和免疫识别。但PEG化水平是一把双刃剑:过低会导致稳定性差和快速清除;过高则可能影响纳米颗粒的稳定性和细胞摄取,这就是所谓的“PEG困境”。因此,系统研究PEG化水平对纳米药物从制备、理化性质、体外行为到体内命运的全过程影响,对于设计更有效的化疗纳米药物至关重要。
本研究旨在深入探讨表面工程,特别是不同PEG化水平,对SN38前药纳米组装体(NPs)的全面影响,为改善其体内递送提供新的解决方案。
为开展本研究,作者团队运用了几个关键的技术方法:1. 通过纳米沉淀法制备了具有不同DSPE-mPEG2k/前药质量比(0%, 5%, 20%, 40%, 60%, 80%, 100%, 150%, 200%)的SN38前药NPs。2. 利用动态光散射(DLS)、透射电子显微镜(TEM)和高效液相色谱(HPLC)对NPs的粒径、电位、形态、载药量和稳定性进行了系统表征。3. 使用肿瘤细胞裂解液模拟释放环境,并通过HPLC评估药物释放动力学。4. 采用MTT法测定细胞毒性,并创新性地应用液相色谱-质谱联用技术(LC-MS)对细胞内的药物摄取和释放进行精确定量分析。5. 在斯普拉格-道利(Sprague-Dawley)大鼠模型中进行药代动力学研究,在携带CT26结肠肿瘤的BALB/c小鼠模型中评估生物分布和抗肿瘤功效,所有体内实验样品均通过LC-MS进行定量分析。6. 通过检测结肠长度评估肠道毒性,并通过酶联免疫吸附测定(ELISA)试剂盒检测抗PEG免疫球蛋白(IgM, IgG)和过敏毒素(C3a, C5a)水平,以评估加速血液清除(ABC)效应。
Preparation and characterization of the SN38 prodrug NPs
研究人员成功合成了C12桥连的SN38二聚体前药,其纯度超过99%。分子模拟表明,该前药相较于SN38单体具有更强的分子间结合能(-53.84 vs. -37.28 kcal/mol),表明其更强的自组装倾向。然而,单纯由前药自组装形成的纳米颗粒(0% NPs)稳定性差,被排除在后续研究之外。通过引入不同比例的DSPE-mPEG2k进行表面工程,制备了一系列PEG化水平的NPs(5%-200%)。表征结果显示,所有PEG化NPs均具有高载药量(>25%)和球形形态。粒径随PEG化水平增加而增大,200% NPs时组装体结构被破坏。稳定性测试表明,在生理条件(含30%胎牛血清的PBS)下,20%-80% NPs表现出良好的稳定性,而低PEG化(5%)和高PEG化(100%-200%)的NPs稳定性较差。离心破坏实验进一步证实,60%和80% NPs在机械应力下能保持最好的结构完整性。

In vitro behavior of the SN38 prodrug NPs
药物释放研究显示,较高的PEG化水平会加速SN38在肿瘤细胞裂解液中的释放,这可能是由于亲水性表面便于释放介质渗透。CPT-11在肿瘤细胞裂解液中几乎不释放SN38。细胞毒性实验表明,80% NPs的抑制作用最强,而200% NPs最弱,这与释放趋势并不完全一致,提示细胞毒性可能与细胞摄取和细胞内释放速率更相关。细胞内SN38释放量的测定结果与细胞毒性趋势相符。细胞摄取定量分析揭示,80% NPs的摄取量最高,这得益于其适中的PEG化水平、优化的粒径和卓越的稳定性。20% NPs虽粒径小但因稳定性差导致摄取低,150% NPs则因高PEG化和大粒径而细胞摄取最低。研究表明,在该系统中,细胞摄取是决定细胞毒性的主导因素。
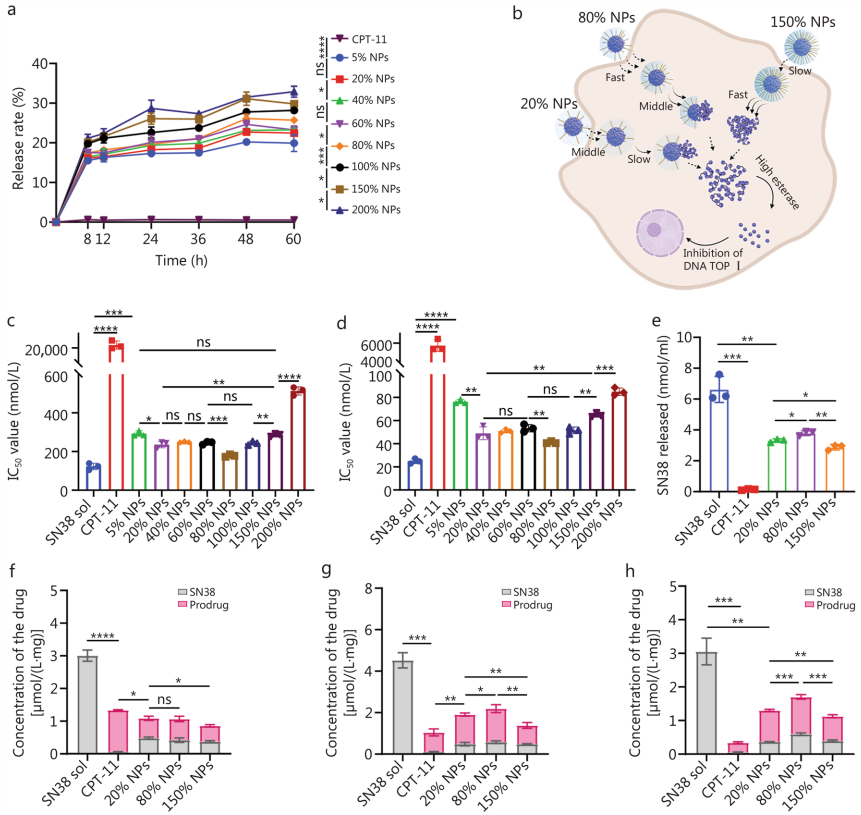
In vivo behavior of the SN38 prodrug NPs
体内药代动力学研究显示,SN38溶液和CPT-11的血药浓度迅速下降。相比之下,SN38前药NPs的药代动力学性能显著改善。尽管80% NPs在体外表现最佳,但其体内药代动力学并无优势。150% NPs展现出最优的血药浓度-时间曲线,其SN38与前药总AUC值是CPT-11的12.97倍,是80% NPs的7.09倍。高PEG化为150% NPs提供了有效的免疫屏蔽,极大增强了其系统循环稳定性,其在血液中的SN38泄漏率低于2%,半衰期延长至18.43小时。而20%和80% NPs则被MPS快速清除,并释放了近50%的SN38。

生物分布研究表明,SN38溶液和CPT-11能快速分布到正常器官。而SN38前药NPs的肿瘤蓄积显著改善,其中150% NPs的表现最佳,其在注射后1小时的肿瘤蓄积量是CPT-11的15.32倍,是80% NPs的5.44倍。肿瘤组织(CT26)的CD31染色显示其血管密度显著高于正常组织,这与增强的渗透与滞留(EPR)效应介导的NPs积累相关。150% NPs在1小时时表现出最高的肿瘤/器官、肿瘤/肝和肿瘤/脾比值,证实了其优先的肿瘤靶向性。
Antitumor efficacy and safety of the SN38 prodrug NPs
在CT26荷瘤小鼠模型中,150% NPs表现出最强的抗肿瘤功效,其肿瘤细胞凋亡水平最高,增殖水平最低。安全性评估显示,在给药剂量下,各组小鼠均未出现显著的体重下降。针对SN38特有的肠道毒性,通过测量结肠长度进行评估,结果显示仅有150% NPs组的结肠长度与生理盐水组相比无显著变化,而SN38溶液、CPT-11、20% NPs和80% NPs组均出现显著的结肠缩短,表明存在严重的肠道毒性。这得益于150% NPs在循环中的稳定性,防止了SN38的提前泄漏。血液学常规检查以及肝肾功能检测表明所有组均无显著毒性。此外,重复注射150% NPs并未引发抗PEG IgM/IgG抗体水平的升高或补体C3a/C5a的激活,表明其诱导ABC效应的风险很低,具有良好的生物相容性。

讨论与结论
本研究深刻揭示了表面工程对SN38前药纳米组装体行为的“双重性格”:其在体外和体内的影响可以是背道而驰的。低PEG化(20% NPs)导致稳定性差和快速清除;中等PEG化(80% NPs)虽拥有最佳的体外稳定性、细胞摄取和细胞毒性,但其PEG层仍不足以在体内完全避免MPS的清除;高PEG化(150% NPs)则提供了有效的免疫屏蔽,显著改善了药代动力学、肿瘤蓄积,并最终带来了卓越的抗肿瘤疗效,且不诱导ABC效应。
研究结果强调了在纳米药物设计中,表面工程与前药化学本身同等重要。对于SN38这类难溶性化疗药物,确保长的系统循环时间和高的肿瘤绝对蓄积量比最大化单个细胞的摄取效率更为关键。本研究中采用的基于前药自组装的NPs,其PEG化仅用于增强循环时间,药物释放后NPs会解离,避免了空PEG载体长期循环可能引发的免疫反应,这可能是其未观察到ABC效应的重要原因。
综上所述,本研究通过系统调控PEG化水平,成功优化了SN38前药纳米药物的性能。高PEG化(150% NPs)策略在体内实现了长循环、高肿瘤靶向、强抗肿瘤疗效和低毒性的理想平衡,为克服“PEG困境”、设计更安全有效的化疗纳米药物提供了重要的理论与实践依据。该研究成果发表于《Military Medical Research》期刊。
 生物通微信公众号
生物通微信公众号
知名企业招聘