
-

生物通官微
陪你抓住生命科技
跳动的脉搏
犬弓首蛔虫成虫排泄分泌蛋白的蛋白质组学解析:揭示寄生虫-宿主互作机制与免疫干预新靶点
【字体: 大 中 小 】 时间:2025年09月23日 来源:BMC Genomics 3.7
编辑推荐:
本刊推荐:针对犬弓首蛔虫(Toxocara canis)成虫期排泄分泌蛋白(ESPs)分子表征缺失的问题,研究人员采用Orbitrap Astral质谱仪开展性别差异性蛋白质组学研究,鉴定到2,513个ES蛋白(含292个雌性特异性和117个雄性特异性蛋白),通过Co-IP技术筛选出150个免疫互作蛋白(如14-3-3-like protein 2、HSP70等),发现PI3K-Akt、JAK-STAT等关键通路富集,为理解寄生虫免疫逃避机制和开发人兽共患弓蛔虫病新型疗法提供重要理论依据。
在全球范围内,犬弓首蛔虫(Toxocara canis)作为一种重要的人兽共患寄生虫,每年导致数百万人感染,尤其对儿童和青少年群体构成严重健康威胁。这种寄生虫可通过污染土壤、蔬菜和水源传播,引发内脏幼虫移行症、眼幼虫移行症甚至神经系统病变。尽管科学家们早已认识到寄生虫的排泄分泌产物(Excretory-Secretory Products, ESPs)在调控宿主免疫反应和促进寄生虫生存中扮演关键角色,但长期以来,对成虫阶段ES蛋白的系统性研究仍存在显著空白。以往研究多集中于第三阶段幼虫(L3)的ES蛋白或成虫非蛋白组分,而成虫在犬只肠道内持续释放的免疫调节分子及其作用机制尚未明确。
为了解决这一科学问题,Zhou等研究人员利用高通量蛋白质组学技术,首次对雌雄成虫的ES蛋白进行了全面解析。该研究采用先进的Orbitrap Astral质谱仪,结合窄窗口数据非依赖采集(nDIA)技术,实现了对低丰度蛋白的高灵敏度检测。通过比较蛋白质组学分析,不仅揭示了性别特异性表达模式,还通过共免疫沉淀(Co-IP)技术筛选出与宿主抗体相互作用的关键抗原蛋白,为开发新型诊断方法和疫苗候选靶点提供了重要数据支持。这项研究成果发表于《BMC Genomics》,为寄生虫与宿主互作研究提供了新的视角。
研究人员主要应用了以下关键技术:首先采用 Orbitrap Astral 质谱仪进行高分辨率蛋白质组学分析,通过数据非依赖采集(DIA)模式鉴定蛋白质;利用共免疫沉淀(Co-IP)结合质谱技术筛选免疫互作蛋白;通过生物信息学方法(包括Euk-mPLoc 2.0亚细胞定位预测、AnimalTFDB 4.0转录因子分析、GO和KEGG通路富集分析)进行功能注释;使用平行反应监测(PRM)技术对关键蛋白进行验证。所有实验均使用来自实验室比格犬模型的成虫样本(感染后90天采集)。
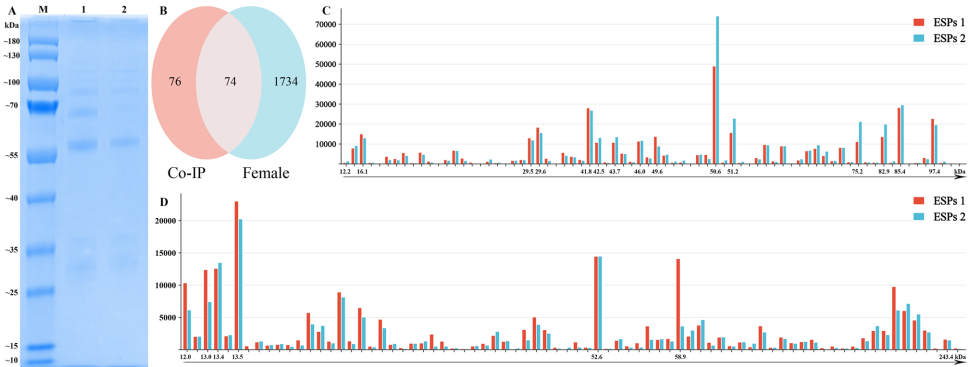
研究通过高精度质谱技术鉴定到2,513个ES蛋白,其中1,516个为雌雄共有蛋白。性别特异性分析显示292个雌性特有蛋白和117个雄性特有蛋白,表明两性在生理功能上存在显著差异。主成分分析(PCA)显示雌雄样本明显分离,蛋白质表达谱具有高度性别特异性。通过平行反应监测(PRM)验证了七种代表性蛋白的表达趋势,证实了蛋白质组数据的可靠性。
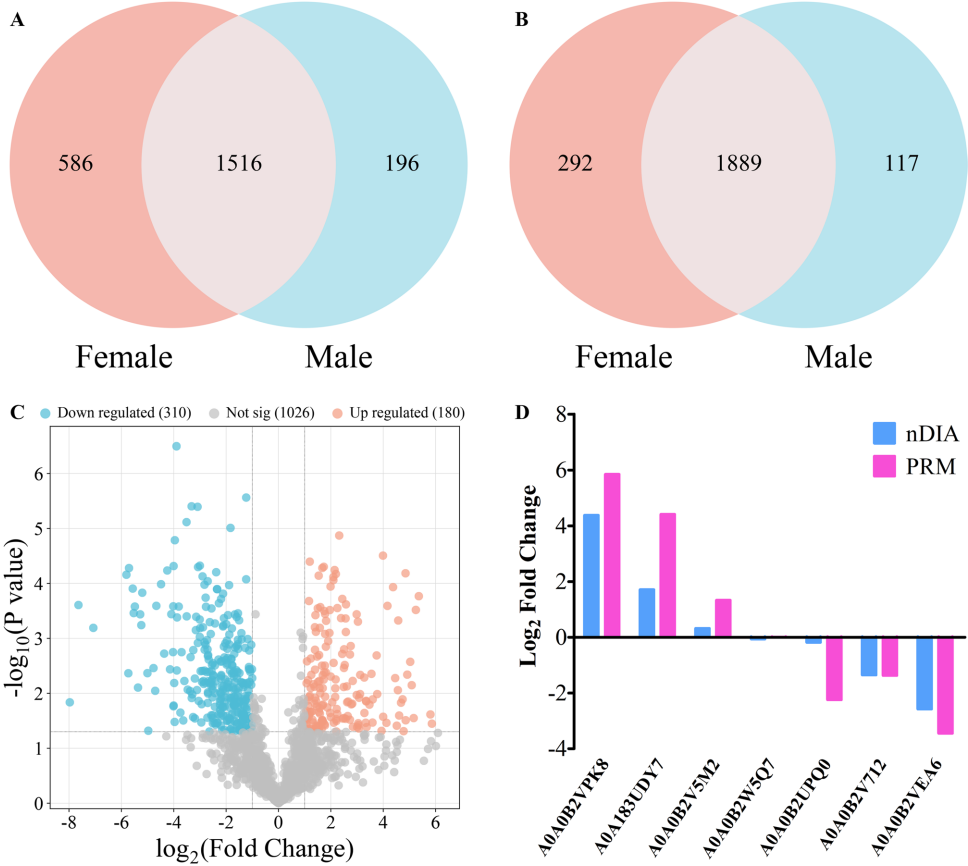
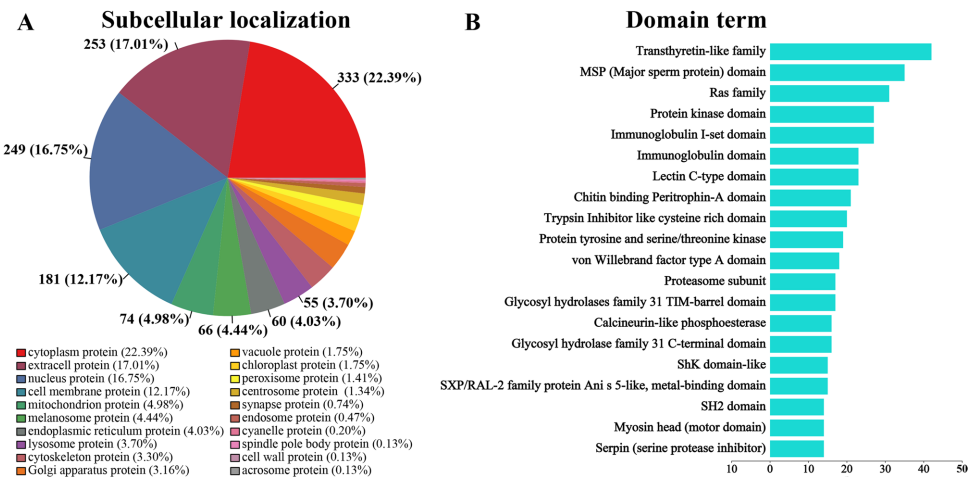
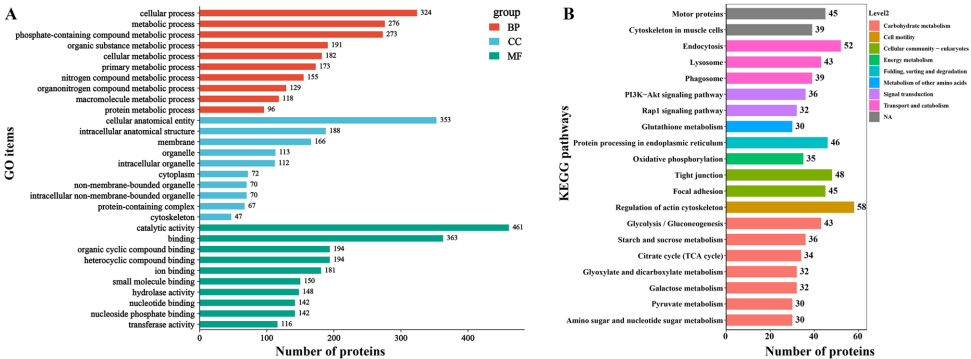
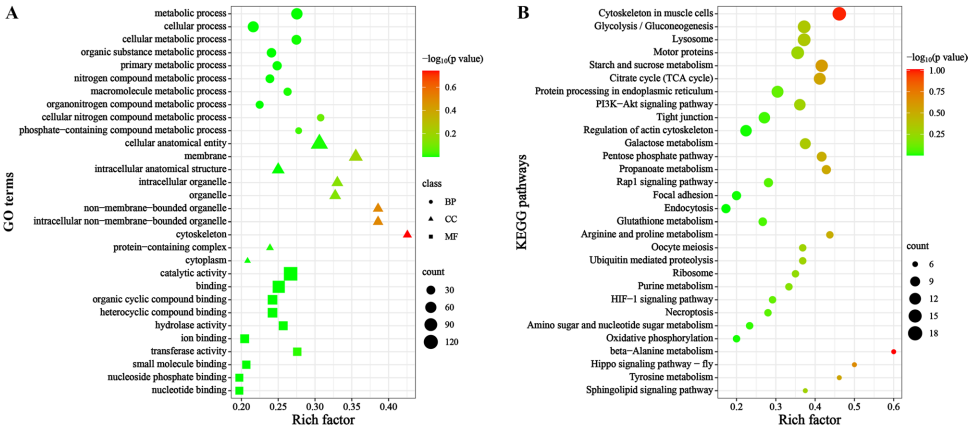
亚细胞定位预测显示22.39%的ES蛋白定位于细胞质,17.01%为胞外蛋白,提示这些蛋白可能直接参与宿主互作。结构域分析发现转运甲状腺素蛋白样家族结构域(42个蛋白)和主要精子蛋白(MSP)结构域(35个蛋白)最为富集。GO功能注释显示蛋白主要参与催化活性和结合功能,KEGG通路分析显著富集于PI3K-Akt、Rap1、MAPK等信号通路,这些通路与免疫调节和细胞存活密切相关。
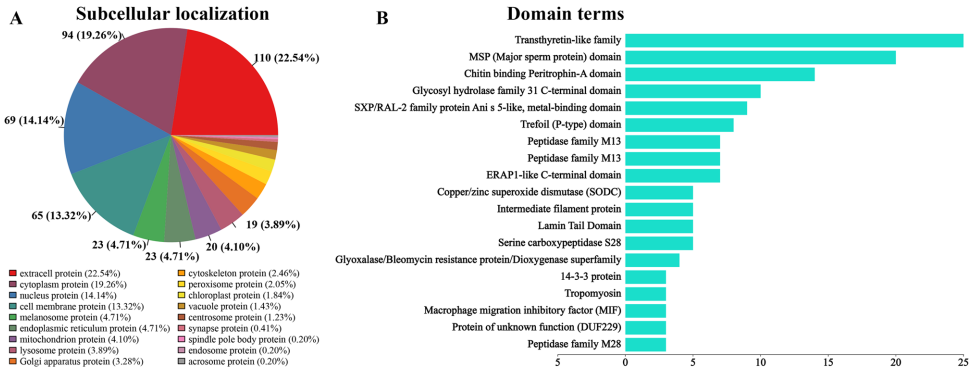
对899个差异性表达蛋白(PDAs)的分析显示,110个胞外蛋白中存在显著性别差异(68个雌性上调,42个雄性上调)。转录因子鉴定发现7个差异性TF蛋白,包括ZBTB、CSD和MYB家族成员。结构域富集分析显示转运甲状腺素蛋白样家族结构域(25个蛋白)和MSP结构域(20个蛋白)最为显著,表明这些蛋白可能在性别特异性功能中发挥重要作用。
GO功能富集显示285个PDAs蛋白显著参与催化活性和分子功能调节。KEGG通路分析发现"脂肪酸延伸"和"蛋白输出"通路显著富集,表明性别差异性蛋白可能参与脂质代谢和蛋白分泌过程。这些通路与寄生虫的营养获取和宿主免疫调节密切相关。
通过Co-IP技术鉴定出150个与宿主抗体相互作用的ES蛋白,其中74个与直接蛋白质组数据集重叠。这些免疫互作蛋白包括14-3-3-like protein 2、26S蛋白酶调节亚基、微管蛋白、热休克蛋白70(HSP70)和烯醇酶等关键分子。许多高表达蛋白如HSP70和GAPDH(甘油醛-3-磷酸脱氢酶)被认为是潜在的疫苗候选抗原。
研究结论表明,该研究首次提供了犬弓首蛔虫成虫ES蛋白的全面蛋白质组谱,揭示了显著的性别差异性表达模式。鉴定到的关键免疫互作蛋白如14-3-3-like protein 2和热休克蛋白家族成员,为理解寄生虫免疫逃避机制提供了新的分子基础。这些发现不仅深化了对寄生虫-宿主互作机制的认识,而且为开发针对人兽共患弓蛔虫病的新型治疗策略和疫苗设计提供了重要的靶点资源。特别值得注意的是,研究中发现的性别特异性表达蛋白可能反映了雌雄寄生虫在繁殖和宿主适应方面的不同生物学需求,这为后续研究提供了新的方向。
讨论部分进一步强调,与L3幼虫期相比,成虫ES蛋白组成存在显著差异,如C型凝集素TES-32(Tc-CTL-1)在成虫中缺失,而转运甲状腺素蛋白样家族在成虫中高度表达,表明不同发育阶段采用不同的免疫 evasion 策略。这些发现对改进现有诊断方法和开发阶段特异性干预措施具有重要意义。此外,研究采用的Co-IP技术成功鉴定了低丰度免疫原性蛋白,证明了该方法在发现潜在疫苗候选抗原方面的优势。
 生物通微信公众号
生物通微信公众号
知名企业招聘