
-

生物通官微
陪你抓住生命科技
跳动的脉搏
C末端延伸泛素前体通过调控蛋白质稳态和线粒体自噬促进长寿的新机制
【字体: 大 中 小 】 时间:2025年09月24日 来源:Molecular Cell 16.6
编辑推荐:
本刊推荐:研究人员针对应激条件下蛋白质稳态维持机制这一关键问题,开展了关于C末端延伸泛素(CxUb)的功能特性研究。通过酵母和线虫模型,发现CxUb特异性地与E4泛素连接酶Ufd2结合,介导底物蛋白的泛素化降解,从而促进线粒体自噬(mitophagy)和延长寿命。该研究揭示了CxUb作为一种新型应激特异性泛素变体的独特功能,为理解蛋白质质量控制机制提供了新视角,对衰老相关疾病治疗具有重要启示意义。
在真核细胞中,泛素(ubiquitin)作为一种高度保守的蛋白质修饰剂,通过调控靶蛋白的稳定性和功能,在维持细胞稳态中发挥核心作用。泛素通常以多聚泛素前体的形式合成,经过加工后形成成熟的泛素单体。有趣的是,在所有真核生物中,多聚泛素基因编码的最后一个泛素单元总保留着一个C末端的延伸序列,这种结构特征在进化上高度保守,但其生理功能长期以来却是个未解之谜。
传统的观点认为,多聚泛素基因的上调主要是为了在应激条件下增加细胞内泛素的库存量。然而,过度表达成熟泛素并不能完全弥补多聚泛素基因缺失导致的表型缺陷,暗示着这些基因可能具有超越单纯提供泛素单体的功能。更令人困惑的是,人工构建的N端泛素融合蛋白(如Ub-β-半乳糖苷酶)能够被E4泛素连接酶Ufd2识别并引导其通过泛素融合降解(UFD)途径进行降解,但相应的内源性等价物一直未被发现。这些未解问题促使研究人员思考:C末端延伸的泛素形式是否可能就是这些人工底物的内源性对应物?它们是否在应激响应中扮演着特殊角色?
为了回答这些问题,Selver Altin等研究人员在《Molecular Cell》上发表了他们的最新研究成果。他们发现这种C末端延伸的泛素(C-terminally extended ubiquitin, CxUb)不仅是UFD途径中人工底物的内源性等价物,更是一种具有应激特异性功能的泛素变体,在酵母和线虫中对于应激抵抗、线粒体自噬和长寿都至关重要。
研究人员主要运用了分子遗传学操作(包括CRISPR-Cas9基因编辑技术)、蛋白质生化分析(如免疫共沉淀和体外泛素化实验)、细胞生物学技术(如显微镜观察和报告基因检测)以及模式生物(酿酒酵母和秀丽隐杆线虫)实验等技术方法。其中,通过构建一系列泛素拷贝数不同的酵母菌株,并结合特异性检测CxUb的抗体和质谱分析技术,为揭示CxUb的独特功能提供了关键证据。
CxUb是应激抵抗的关键要素
研究人员首先通过系统分析酿酒酵母中多聚泛素基因UBI4(编码5个泛素重复单元)不同变异株的应激表型,发现了一个令人惊讶的现象:只要保留最后一个泛素单元的C末端延伸(天冬酰胺N77),即使只有一个泛素拷贝,也足以维持正常的应激抵抗能力;而缺失这个单一的N77残基,则会导致细胞对热应激、金属毒性、氨基酸类似物等多种应激条件的敏感性显著增加。
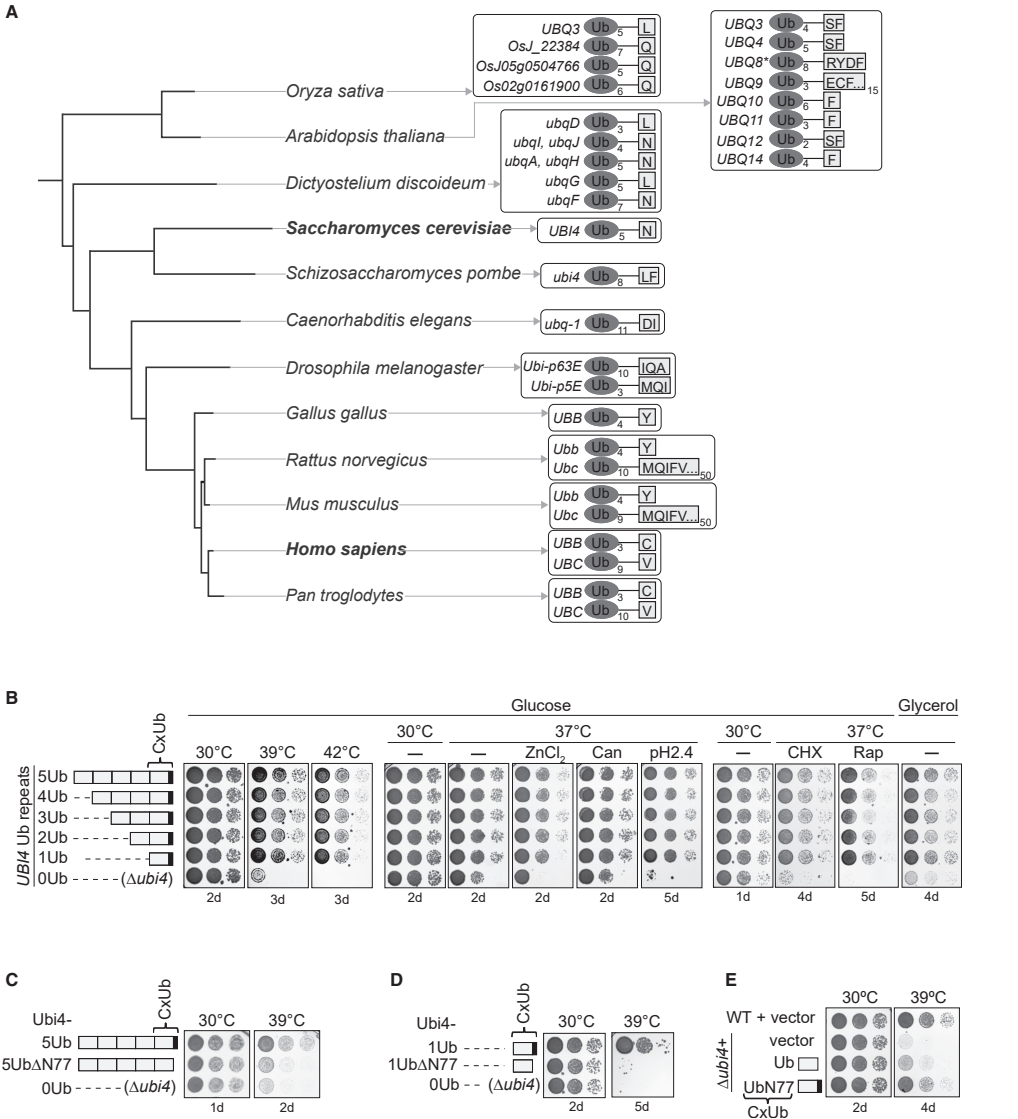
更重要的是,这种应激敏感性不能简单地归因于细胞内泛素总体水平的改变,因为各变异株之间的泛素谱并没有显著差异。这些结果表明,CxUb代表了一种功能独特的泛素实体,专门用于介导应激响应。
CxUb调控线粒体自噬和寿命
由于泛素化在线粒体质量控制和自噬中起着核心作用,研究人员进一步探讨了CxUb在线粒体自噬(mitophagy)中的功能。通过使用碱性磷酸酶(ALP)报告系统和新颖的线粒体靶向荧光报告基因,他们发现缺失UBI4或特异性去除C末端N77延伸都会严重损害线粒体向液泡的运输和降解过程。

值得注意的是,这种缺陷并非由于核心自噬机制(如Atg8脂化或自噬体形成)的普遍功能障碍,而是更加特异性的调控失效。与此一致的是,CxUb的缺失也会显著缩短酵母的时序寿命(chronological lifespan),表明其在衰老调控中的重要作用。
CxUb在线虫中的保守功能
为了验证CxUb功能的进化保守性,研究人员利用CRISPR-Cas9技术在秀丽隐杆线虫中构建了CxUb缺失突变体。结果显示,在线虫中删除CxUb同样会导致寿命缩短和线粒体自噬缺陷,特别是在线粒体去极化剂CCCP或线粒体蛋白frataxin(frh-1)敲低诱导的应激条件下。

这些发现表明,CxUb在调节线粒体质量控制和寿命方面的功能在真核生物中是高度保守的,提示其在高等生物中可能具有类似的生理和病理意义。
CxUb的加工和结合特性
研究人员进一步探究了CxUb发挥功能的结构基础。他们发现,CxUb必须经过去泛素化酶(DUB)加工去除C末端延伸,并且其C末端的甘氨酸(G75和G76)必须保持完整才能进行有效的泛素化结合。有趣的是,C末端延伸的具体氨基酸组成并不重要——无论是天然的天冬酰胺,还是其他氨基酸替换,甚至更长的延伸,都能支持CxUb的功能。
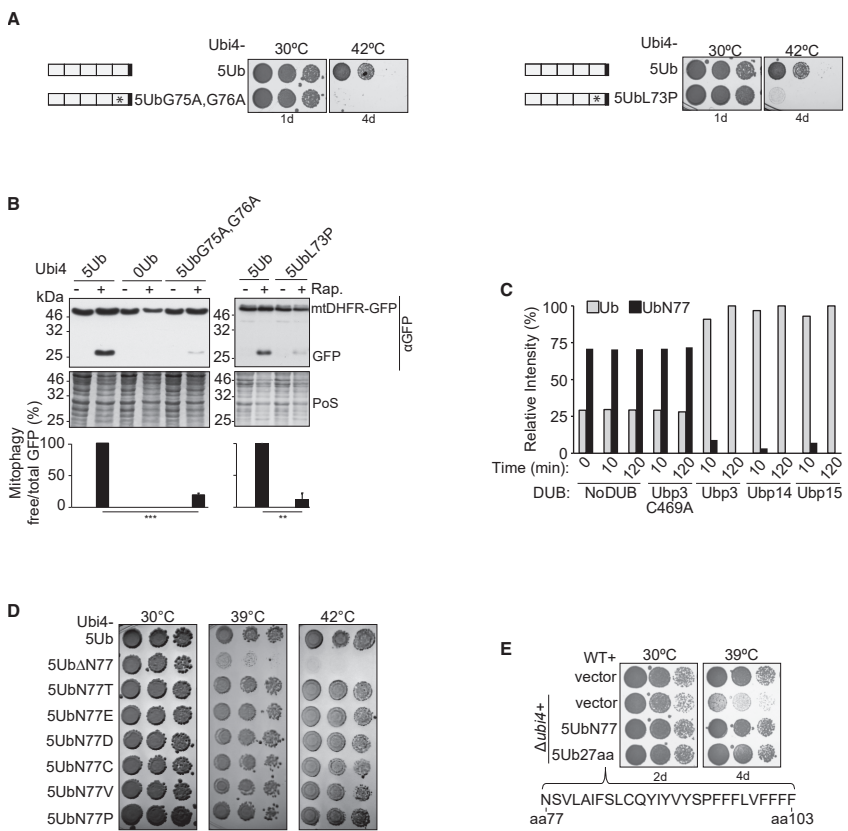
这一发现解释了为什么不同物种中C末端延伸的序列存在较大变异,但功能却得以保留。
CxUb与Ufd2的特异性相互作用
研究人员发现CxUb与E4泛素连接酶Ufd2之间存在特异性的相互作用。通过免疫共沉淀实验,他们证明Ufd2与CxUb的结合明显强于与普通泛素的结合,并且这种相互作用不依赖于Ufd2已知的泛素结合结构域(UBD)或U-box结构域,而是通过Ufd2中部的一个先前未被识别的结合区域介导。

AlphaFold2多聚体建模预测CxUb位于Ufd2核心区域的两个臂之间,且E2酶Ubc4的催化半胱氨酸86与CxUb的K48非常接近(4.3?),为这种特异性相互作用提供了结构基础。
CxUb介导的底物泛素化和降解机制
研究人员发现,CxUb和Ufd2共同促进内源性底物蛋白的泛素化和蛋白酶体降解。以线粒体融合蛋白Fzo1(酵母中的mitofusin同源物)为例,在诱导线粒体自噬时,Fzo1会发生Ufd2和CxUb依赖性的泛素化修饰和降解。同样,激酶Mps1的稳定性也受到CxUb和Ufd2的调控。

更重要的是,在全局水平上,缺失CxUb或Ufd2会导致高分子量泛素化底物的积累和周转障碍,特别是在蛋白酶体被抑制的条件下更为明显。这些结果表明,CxUb-Ufd2通路在应激条件下放大泛素信号,促进底物蛋白的有效降解。
CxUb上的泛素链组装
研究人员还发现,未加工的CxUb可以作为泛素链组装的受体,形成未锚定的多聚泛素链。这些链特别是在应激条件下(如热激)积累,并且依赖于Ufd2的存在。

研究人员提出了一种模型:Ufd2作为平台,首先在CxUb上组装泛素链,然后经过DUB加工去除C末端延伸,将预形成的链整体转移到底物蛋白上,从而高效地靶向底物进行蛋白酶体降解。
该研究揭示了C末端延伸泛素(CxUb)作为一种新型应激特异性泛素实体的独特功能。CxUb不同于常规泛素,它专门用于在应激条件下维持蛋白质稳态,通过特异性结合E4泛素连接酶Ufd2,促进底物蛋白的泛素化和蛋白酶体降解。这一机制对于线粒体自噬和寿命调控至关重要,且在酵母和线虫中保守。
这些发现解决了长期以来关于多聚泛素基因功能和C末端延伸意义的谜题,并建立了人工UFD底物与内源性CxUb之间的功能联系。更重要的是,CxUb提供了一种潜在的治疗策略:特异性靶向应激条件下的泛素化过程,而不干扰常规的看家功能,可能避免当前蛋白酶体抑制剂在肿瘤治疗中的严重毒副作用。
从更广泛的视角来看,这项工作扩展了我们对泛素密码的理解,揭示了应激特异性泛素信号的新层面,为多种泛素相关人类疾病(如神经退行性疾病、癌症和衰老相关疾病)的病理机制研究和治疗开发提供了新的思路和靶点。
 生物通微信公众号
生物通微信公众号
知名企业招聘