
-

生物通官微
陪你抓住生命科技
跳动的脉搏
RSK1通过磷酸化UBE2L6调控cGAS泛素化抑制抗肿瘤免疫的机制研究
【字体: 大 中 小 】 时间:2025年09月24日 来源:Cell Reports 6.9
编辑推荐:
本刊推荐:针对免疫检查点阻断(ICB)治疗响应率低的难题,研究人员开展RSK1-UBE2L6-RNF19A信号轴调控cGAS K33连锁泛素化的机制研究。发现RSK1磷酸化UBE2L6第26位丝氨酸,使其从ISG15结合酶转换为泛素结合酶,与RNF19A协同抑制cGAS活性从而削弱I型干扰素应答。靶向RSK1或阻断UBE2L6磷酸化可显著增强免疫治疗及放疗效果,为联合治疗策略提供新靶点。
免疫检查点阻断(ICB)疗法虽然为癌症治疗带来革命性突破,但在多数患者中仍面临固有耐药性的严峻挑战。肿瘤细胞通过复杂机制逃避免疫监视,其中泛素化修饰系统作为关键调控因子尚未被充分探索。近年来研究发现E3泛素连接酶可调控肿瘤细胞对免疫治疗的敏感性,但具体机制及治疗靶点仍有待揭示。
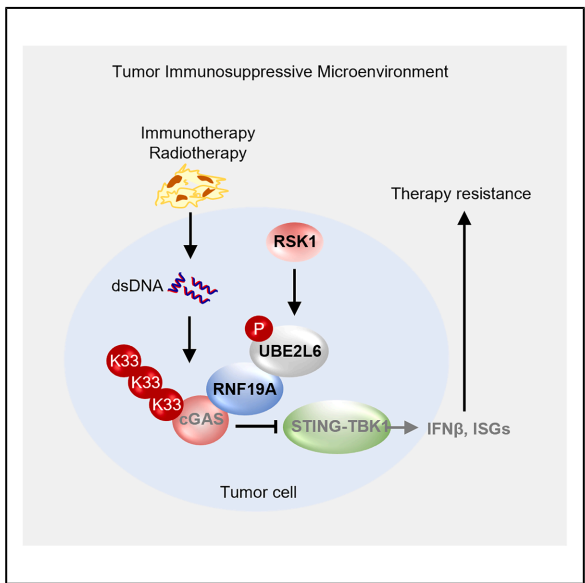
为解决这一问题,Peng等研究人员通过体内CRISPR筛选技术,发现RBR家族E3连接酶RNF19A是潜在的免疫抑制因子。进一步研究揭示RNF19A通过促进cGAS蛋白的K33连锁泛素化修饰,抑制其介导的I型干扰素应答通路。令人惊讶的是,干扰素诱导的ISG15结合酶UBE2L6竟在此过程中充当泛素结合酶的角色。更深入机制研究表明,RSK1激酶通过对UBE2L6第26位丝氨酸的磷酸化修饰,改变其底物特异性,从ISG15转向泛素,从而将UBE2L6从免疫应答增强剂转变为免疫抑制因子。这项发表于《Cell Reports》的研究不仅揭示了肿瘤细胞内在免疫逃避的新机制,更为联合免疫治疗提供了新的策略方向。
研究人员运用多种关键技术方法:通过体内CRISPR-Cas9筛选鉴定免疫调节基因;采用同位素标记相对和绝对定量(SILAC)结合质谱技术分析泛素化修饰谱;利用核磁共振(NMR)解析蛋白质结构变化;建立多种小鼠肿瘤模型(包括皮下移植瘤和原位胶质瘤模型)进行体内功能验证;采用单细胞RNA测序(scRNA-seq)分析肿瘤免疫微环境;并通过临床组织芯片分析患者样本与预后的相关性。
研究结果
体内筛选鉴定RBR E3连接酶RNF19A促进免疫逃避
通过构建靶向1,233个E3相关基因的CRISPR文库,在MC38小鼠结肠癌模型中进行体内筛选,发现Rnf19a缺失显著增强PD-1阻断剂的抗肿瘤效果。在多种肿瘤模型(MC38、CT-2A胶质母细胞瘤、B16F10黑色素瘤)中证实Rnf19a缺失使肿瘤对免疫治疗和放射治疗敏感化。单细胞RNA测序显示Rnf19a缺失肿瘤中免疫细胞浸润模式改变,CD8+ T细胞和NK细胞增加,M2型巨噬细胞减少,I型干扰素信号通路显著激活。
RNF19A以cGAS依赖方式限制干扰素应答
定量质谱分析发现cGAS是RNF19A的关键底物。RNF19A通过其N端结构域与cGAS直接结合,催化cGAS发生K33连锁的多聚泛素化修饰。这种修饰不影响cGAS蛋白稳定性,但抑制其二聚化和寡聚化过程,从而减少cGAMP产生和下游STING-TBK1信号通路激活。在Cgas缺失细胞中,Rnf19a缺失不再能增强干扰素应答,证实该调控的cGAS依赖性。

UBE2L6介导cGAS的K33连锁泛素化
研究发现UBE2L6(而非UBE2E2或UBE2L3)是RNF19A催化cGAS K33连锁泛素化的关键E2结合酶。Ube2l6缺失显著降低cGAS泛素化水平,增强DNA刺激后的干扰素β表达。动物实验表明Ube2l6缺失肿瘤对免疫治疗和放疗的敏感性依赖cGAS和I型干扰素受体(Ifnαβr1),并伴随CD8+ T细胞浸润增加。
UBE2L6磷酸化转换其底物特异性
UBE2L6通常作为ISG15结合酶促进ISG化修饰,但研究发现其第26位丝氨酸(S26)磷酸化可改变其功能。通过质谱和磷酸化特异性抗体证实S26在体内外均可被磷酸化。核磁共振和AlphaFold结构预测显示S26磷酸化使UBE2L6与泛素的空间距离缩短,与ISG15的距离增加,从而促进泛素化而抑制ISG化。S26D(磷酸化模拟突变)促进cGAS泛素化并抑制免疫治疗反应,而S26A(去磷酸化突变)则产生相反效果。

RSK1磷酸化UBE2L6
通过激酶组CRISPR筛选监测STING S366磷酸化,发现RSK1(RPS6KA1)是调控UBE2L6磷酸化的关键激酶。Rsk1缺失减少cGAS泛素化,增加ISG化,增强DNA刺激后的干扰素应答。体外实验证实磷酸化的UBE2L6增强cGAS K33连锁泛素化。
靶向RSK1增强免疫和放疗效果
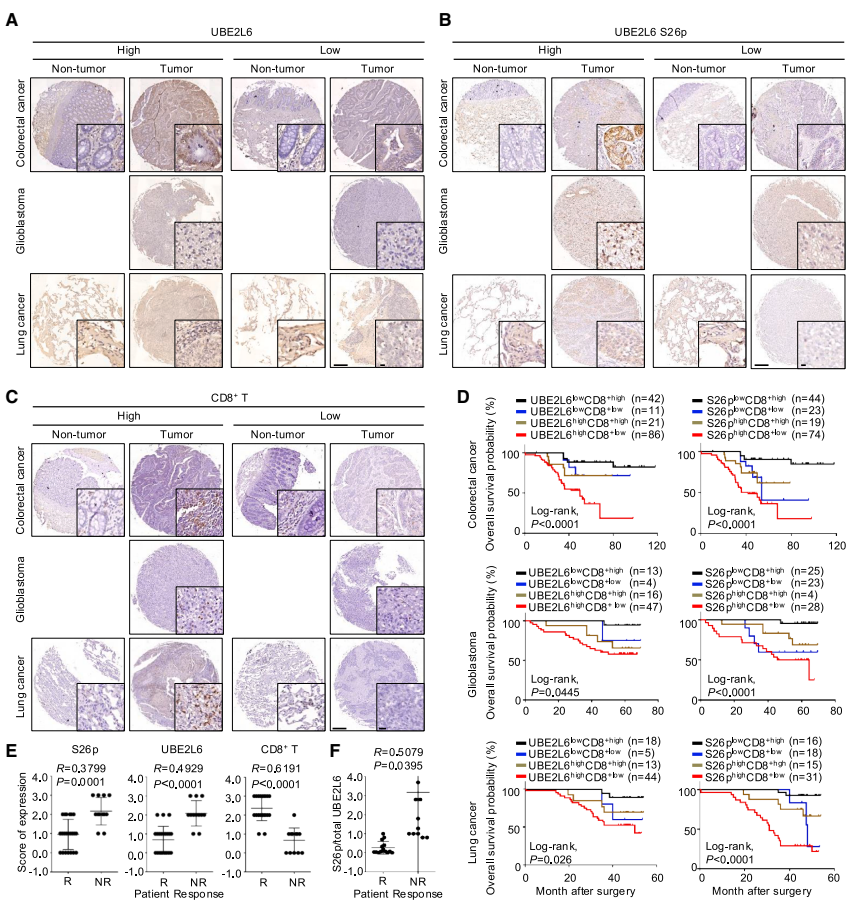
RSK抑制剂PMD-026(目前处于I/Ib期临床试验)处理显著增强肿瘤对PD-1阻断和放疗的敏感性,该效应依赖UBE2L6。临床数据分析显示RSK1(而非RSK2)高表达与非小细胞肺癌和结直肠癌患者的免疫治疗耐药相关。UBE2L6及其磷酸化水平在多种癌症组织中升高,与CD8+ T细胞浸润负相关,且高表达患者预后较差。
研究结论与意义
本研究揭示了肿瘤细胞内在免疫逃避的新机制:RSK1介导的UBE2L6磷酸化及UBE2L6-RNF19A驱动的cGAS泛素化形成免疫抑制信号轴。这一发现不仅解释了为何干扰素诱导的基因产物UBE2L6在某些情况下反而发挥免疫抑制作用,更重要的是为克服免疫治疗耐药提供了新的联合治疗策略。
研究的创新点在于:发现UBE2L6功能的可塑性——通过单一氨基酸磷酸化即可转换其底物特异性;阐明cGAS新型翻译后修饰调控机制——K33连锁泛素化抑制其活性;验证RSK1-UBE2L6-RNF19A轴作为可药靶点的治疗价值。
临床意义方面,研究证实RSK抑制剂PMD-026可显著增强免疫检查点阻断和放疗效果,且UBE2L6磷酸化水平与患者预后和治疗反应密切相关,这为临床生物标志物开发和患者分层治疗提供了依据。由于RAS-RAF-MEK-ERK-RSK通路在多种肿瘤中异常激活,该发现尤其适用于具有该通路突变的免疫治疗耐药患者。

研究局限性包括难以建立ICB完全耐药模型,且筛选可能识别出免疫检查点非依赖的肿瘤抑制机制。未来研究需进一步探索RSK1-UBE2L6轴在不同肿瘤类型中的普适性,以及与其他免疫调节通路的交互作用。
总之,该研究深入解析了泛素化系统在肿瘤免疫调控中的精细机制,为改善免疫治疗疗效提供了新的靶点和策略,具有重要的理论意义和临床转化价值。
 生物通微信公众号
生物通微信公众号
知名企业招聘