
-

生物通官微
陪你抓住生命科技
跳动的脉搏
GBA突变帕金森病中脑类器官模型的批量可重复性验证与多组学整合分析
【字体: 大 中 小 】 时间:2025年09月24日 来源:iScience 4.1
编辑推荐:
本研究针对帕金森病(PD)体外模型中脑类器官批量间变异性的争议问题,通过构建GBA-N370S突变患者来源的多批次中脑类器官模型,综合运用转录组学、蛋白质组学和代谢组学技术,系统评估了疾病表型的可重复性。研究发现NESC传代次数是比类器官批次更重要的变异来源,早期传代批次可稳定重现GBA-PD相关的多巴胺能神经元丢失、细胞衰老和代谢紊乱等特征表型,证实了中脑类器官作为PD研究模型的可靠性和可重复性。该研究为干细胞衍生模型的标准化应用提供了重要实验依据。
在探索帕金森病(Parkinson's disease, PD)发病机制的漫长征程中,科学家们始终在寻找能够真实模拟人类大脑复杂环境的实验模型。传统的二维细胞培养模型虽然操作简便,却难以再现神经元间三维立体的相互作用网络;而动物模型由于物种间脑解剖结构的显著差异,也无法完全模拟人类神经退行性疾病的病理特征。这种模型系统的局限性严重制约了我们对PD pathogenesis(发病机制)的理解和治疗策略的开发。
近年来,干细胞技术的突破性进展带来了革命性的变化——三维中脑类器官(midbrain organoids)模型应运而生。这些由患者特异性诱导多能干细胞(induced pluripotent stem cells, iPSCs)衍生而来的微型脑组织,能够自发形成具有多巴胺能神经元、星形胶质细胞和多类神经元的复杂三维结构,为在生理相关环境中研究疾病机制提供了前所未有的平台。特别是携带葡萄糖脑苷脂酶(glucocerebrosidase, GBA)基因突变的PD模型,由于该突变是PD最重要的遗传风险因素之一,已成为研究α-突触核蛋白积累和多巴胺能神经元丢失机制的重要工具。
然而,随着类器官技术的广泛应用,科学界开始关注一个关键问题:这类复杂的三维培养系统是否能够产生稳定可重复的实验结果?多步骤的培养protocol(方案)、批次间的差异、细胞传代次数的影响等因素,都可能引入不可控的变异,使得不同实验室之间的研究结果难以直接比较。这种可重复性危机不仅可能误导机制研究,更会严重影响药物筛选和临床转化研究的可靠性。
正是为了解决这一关键问题,卢森堡系统生物医学中心的研究团队在《iScience》上发表了他们的最新研究成果。他们系统性地评估了GBA-PD患者来源中脑类器官模型的批量间变异性,通过多组学整合分析验证了疾病表型在不同批次和不同时间点的可重复性,为类器官模型的标准化应用提供了坚实的数据支持。
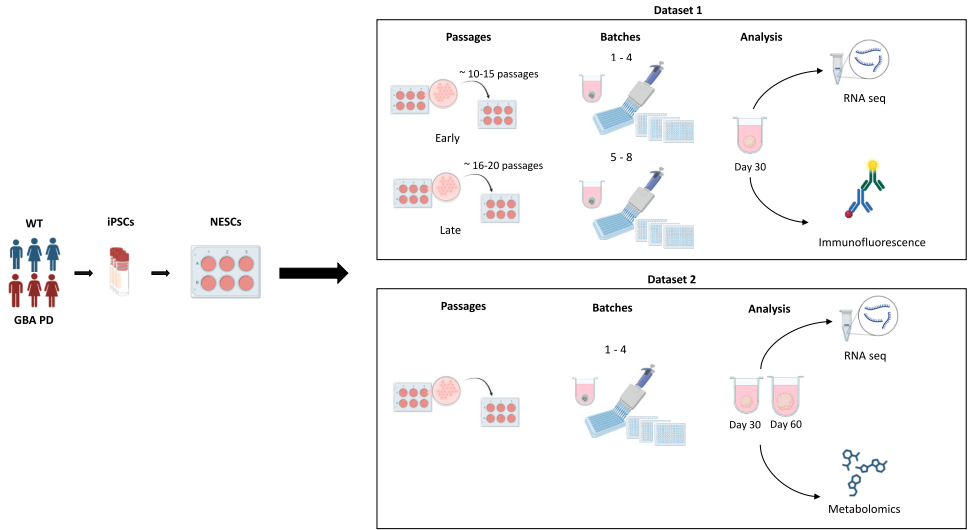
研究人员采用了多项关键技术:首先建立来自3名健康对照和3名GBA-N370S突变PD患者的iPSC细胞系,通过神经上皮干细胞(neuroepithelial stem cells, NESCs)分化和模式化培养生成中脑类器官;设计两个独立数据集(dataset 1包含30天类器官的RNA测序和免疫荧光分析,dataset 2包含30天和60天类器官的转录组和代谢组分析);运用主方差成分分析(principal variance component analysis, PVCA)量化变异来源;通过整体免疫荧光染色和高内涵成像分析多巴胺能神经元和衰老表型;整合转录组与代谢组数据进行多组学关联分析;并基于效应量计算进行统计功效分析,为未来研究提供样本量设计指导。
疾病和细胞传代是中脑类器官培养中变异的关键来源
研究人员通过相关性分析和PVCA发现,在影响类器官转录组数据的各种因素中,疾病状态和供体性别间的交互作用贡献了最大的方差(31.7%),而NESCs的传代次数(passage)贡献了31%的方差,位居第二。相比之下,类器官生成批次仅贡献了5%的方差,其与传代、性别或疾病的交互作用方差贡献可忽略不计。当将数据按早期传代(pE10-15)和晚期传代(pL16-20)分组分析时,发现早期传代批次中疾病状态是最大的方差来源(32.8%),而晚期传代批次中批次间的变异程度加倍(8%),表明使用晚期传代NESCs会增加批次间变异性。
跨独立数据集可重复的转录组疾病特征
研究人员在早期传代批次中鉴定出27个GBA-PD与WT之间共同差异表达基因(DEGs),而晚期传代批次中未发现共同DEGs。这27个基因的功能富集分析显示与细胞衰老(cellular senescence)和凋亡(apoptosis)通路显著相关,其中"bleb assembly"(凋亡泡组装)是最富集的GO通路。这些基因被分为衰老/凋亡通路、突触和神经系统发育、代谢和氧化应激过程、细胞粘附和细胞外基质动态、转录和基因调控等功能类别。当在新生成的dataset 2中验证时,这27个基因的表达模式在培养第30天和第60天都能清晰区分WT和GBA-PD样本,且在更成熟的第60天类器官中区分度更加明显。
蛋白质水平验证多巴胺能神经元和衰老表型证实了转录组疾病特征
通过全mount染色和3D重建,研究发现GBA-PD中脑类器官中酪氨酸羟化酶(tyrosine hydroxylase, TH)阳性的多巴胺能神经元数量显著减少,神经元突触更短、分支更少。TH转录本计数在转录组数据中也显著降低,且在晚期传代批次中表现出更大的异质性。对DNA损伤/衰老标志物53BP1的分析发现,衰老表型在蛋白质水平上出现在晚期传代批次中,而转录组特征在早期传代批次中已显示显著的衰老相关表型。β-半乳糖苷酶染色定性显示GBA-PD中脑类器官中有更强的信号,为PD类器官中衰老增加提供了额外证据。
GBA-PD中脑类器官展示可重复的代谢谱
代谢组学分析显示,大多数代谢物的表达模式在四个批次中保持一致,尽管在第30天时Batch 4表现出与其他批次不同的代谢物丰度 profile(相关性仅0.12),但在第60天时所有批次都显示出显著的相关性(0.59-0.79),表明随着类器官成熟,代谢差异逐渐趋于一致。PCA分析证实代谢profile受样本和疾病状态驱动而非批次效应。整合分析发现丙酮酸(pyruvic acid)、尿素(urea)、甘氨酸(glycine)、葡萄糖(glucose)等在两个时间点都是区分WT和GBA-PD样本的前5个代谢物,且甘氨酸丰度变化与一部分top 50基因负相关,提示甘氨酸代谢及其转录调控在GBA-PD中起重要作用。
使用功效分析进行iPSC衍生模型的样本量估计
基于观察到的效应量,研究人员估计RNA-seq实验需要每组30个样本才能达到80%统计功效(中位数log2 FC=0.42);代谢组学需要每组20个样本(中位数Cohen's d=0.91);而成像实验需要每组50个样本(d=0.56)。这表明通过增加独立实验批次来提高样本量是克服细胞系可用性限制的有效策略,但增加细胞线数量始终优于增加批次数量。
研究的讨论部分强调,尽管中脑类器官模型存在固有复杂性,但通过严格控制关键变异来源,特别是NESCs的传代次数,能够实现高度可重复的疾病建模。早期传代培养 consistently(一致地)产生更稳健和稳定的疾病特异性转录组特征,而晚期传代类器官虽然仍保持核心疾病相关特征,但表现出更大的变异性和转录组老化迹象,这可能使其更适合模拟晚期表型。
该研究的局限性包括仅关注GBA-N370S突变PD患者,可能限制结果对其他PD遗传背景的普适性;相对较少的独立供体细胞系可能无法完全捕捉患者异质性;以及性别特异性效应的系统研究需要更平衡的供体性别分布和最小化的技术变异性。
总之,这项研究提供了强有力的证据,表明患者来源的中脑类器官不仅是GBA-PD病理的准确模型,更是一个稳健且可重复的实验系统。通过识别和控制关键变异来源,这些模型为未来旨在揭示疾病机制和加速PD个性化治疗开发的研究奠定了坚实基础。研究人员强调,在细胞系可用性有限的情况下,加入多个批次可以作为提高实验通量的策略,但应始终优先使用多个独立细胞系来确保结果的普遍性和可转化性。




 生物通微信公众号
生物通微信公众号
知名企业招聘