
-

生物通官微
陪你抓住生命科技
跳动的脉搏
压力下保持高效:解脂耶氏酵母连续发酵产β-胡萝卜素的系统评价与建模研究
【字体: 大 中 小 】 时间:2025年09月24日 来源:TRENDS IN Biotechnology 14.9
编辑推荐:
为解决工程菌株在工业化连续发酵中易出现生产不稳定、高产菌株被低产亚群竞争取代的问题,研究人员开展了解脂耶氏酵母产β-胡萝卜素的系统评价研究。通过多模式发酵实验与动力学模型,发现油基培养基可增强产物稳定性和延长生产周期,而氧限制和高稀释率加速生产衰退。该研究为评估菌株工业化潜力和优化生物工艺提供了重要理论和实验依据。
在微生物生物制造的征途上,科学家们一直面临着一个棘手难题:实验室里表现优异的工程菌株,一旦进入工业化大规模发酵罐,往往会出现“水土不服”,产量急剧下降。这种从摇瓶到反应器的鸿沟,阻碍了许多有潜力的生物技术成果走向实际应用。特别是在连续发酵这种能够大幅提升生产效率的模式中,问题更为突出——高产菌株似乎总是竞争不过那些长得更快但生产能力低下的“作弊者”。为什么会这样?又该如何解决?
为了深入探究这一现象背后的机制,一个国际研究团队以产β-胡萝卜素(β-carotene)的解脂耶氏酵母(Yarrowia lipolytica)工程菌株为模型,开展了一项结合精密实验与数学建模的系统性研究。他们的研究成果发表在生物技术领域的权威期刊《TRENDS in Biotechnology》上。
研究者们综合运用了多种发酵模式(分批、补料分批、连续发酵)的比较实验、蛋白质组学分析、荧光显微镜细胞表征以及动力学建模等关键技术方法。实验样本来源于工程菌株在不同碳源(葡萄糖与菜籽油)、不同溶氧条件下的长期发酵过程。
研究结果通过几个方面揭示了关键发现:
不同发酵模式对菌株稳定性的比较
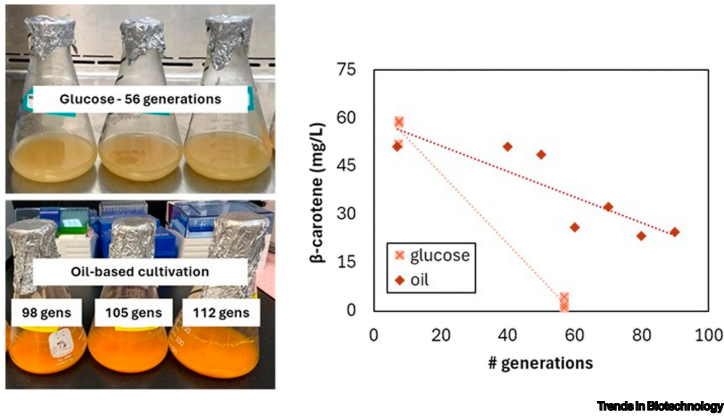
研究发现,菌株的生产稳定性高度依赖于发酵模式。在摇瓶传代培养中,β-胡萝卜素生产能维持超过30代。然而,在连续发酵中,约18代后就出现超过50%的产量损失,而在Ambr250系统中进行的半连续发酵表现最差,仅约11代后产量就损失95%。这凸显了生物反应器环境(如细胞和产物的持续高浓度、剪切应力)对菌株施加的强大选择压力,加速了低产亚群的扩张。

碳源对生产持久性的影响
碳源的选择对生产的维持至关重要。与葡萄糖(YPD培养基)相比,使用菜籽油(YPO培养基)作为碳源时,β-胡萝卜素的产量显著更高,生产持久性也极大延长。在摇瓶传代中,油培养基使生产维持了超过90代,而葡萄糖培养基在约56代后即损失90%以上的产量。油培养基的这种优势归因于多个因素:细胞内脂质体(Lipid Bodies)增大,作为原位萃取剂隔离疏水的β-胡萝卜素,减轻细胞毒性;油脂分解提供丰富的乙酰辅酶A(Acetyl-CoA),为甲羟戊酸途径(Mevalonate Pathway)合成β-胡萝卜素提供前体;此外,油脂中更高的溶氧能力也改善了氧传递。
通气和营养组成的影响
溶氧(Dissolved Oxygen, DO)是另一个关键因素。在限氧条件下(DO设定点为10%),无论是2升连续发酵还是Ambr250半连续发酵,产量下降的速度都显著加快。 insufficient aeration(通气不足)会引发强烈的选择压力,迫使细胞将资源从产物合成转向生存维持。培养基的组成也影响稳定性,营养丰富的YPD培养基能获得比化学成分确定的YNBaa培养基更高的总产量,但后者能提供更高的单位细胞产量和更慢的产量衰退速率。

细胞群体和蛋白质组学分析
通过荧光显微镜观察,研究发现细胞间的β-胡萝卜素积累存在显著的异质性(Heterogeneity)。在发酵后期,特别是在限氧的葡萄糖培养基中,高产细胞群体显著减少。而在油培养基中,即使到了发酵后期,仍能维持一定比例的高产细胞。蛋白质组学分析进一步揭示,在油培养基中,负责β-胡萝卜素合成的关键酶基因(如CarB和CarRP)在发酵后期仍保持高表达水平,这可能是其能维持更久生产的原因之一。

动力学模型揭示亚群动态
研究者开发了动力学模型来模拟不同亚群(高产HI、中等产MED、低产LO和不产NP)在发酵过程中的竞争动态。模型纳入了比生长速率(μmax)、底物半饱和常数(如KiO2)、突变率(MR)和稀释率(D)等参数。模拟结果与实验观察高度一致:在连续发酵中,更高稀释率和溶氧限制(无论是持续低氧还是因混合不均导致的溶氧振荡)都会加速高产菌株被淘汰的过程。模型还揭示了一个重要见解:那些在实验室筛选中被忽视的“中等生”(中等产量但生长更快的菌株),在工业压力环境下可能反而比“最优生”(最高产但生长慢的菌株)更具持久优势,此所谓“败者亦有获”(Losers Take Some)。

研究结论与讨论部分强调,生物制造过程从实验室放大到工业规模时,产量不稳定性是一个主要风险。其背后是多种复杂因素的共同作用:生物反应器中的环境压力(如氧和营养梯度)会引发酵母的代谢转变和二型形态(Filamentation)生长;在长期发酵过程中积累的突变会导致表型异质性, favoring那些具有竞争生长优势但低产的变异体。因此,在实验室设计-构建-测试-学习(Design-Build-Test-Learn, DBTL)循环中优化出的菌株可能缺乏工业环境所需的鲁棒性(Robustness)。
该研究的重要意义在于,它阐明了下游生物工艺条件如何影响上游工程菌株的长期表现,将菌株设计与过程优化更紧密地联系起来。它表明,连续发酵不仅是一种提高生产效率的手段,更可作为一种有效的缩小规模(Scale-down)策略,用于在实验室内提前评估和预测菌株在工业化场景下的 scalability(扩增能力)。为了实现稳健的工业发酵,未来需要采取两种互补策略:一是通过优化培养基组成、混合、生物反应器参数和过程控制来实现“精密发酵”(Precision Fermentations);二是对菌株进行工程化改造,例如减轻代谢负担(Metabolic Burden)、将基因稳定整合到低突变基因组位点,或部署有利于生产亚群生长的合成基因电路(Synthetic Circuits)。
这项工作由Alyssa M. Worland、Vincent A. Xu、Maria F. Duran、Philip Gitman、Kristen Hunter-Cevera、Cinzia Klemm、Yufei Sun、Diego Ruiz Sanchis、Rodrigo Ledesma-Amaro、Kyle R. Pomraning、Deepti Tanjore、Mark Blenner和Yinjie J. Tang合作完成,为克服生物制造规模放大的挑战提供了宝贵的系统级见解和实用框架。
 生物通微信公众号
生物通微信公众号
知名企业招聘