
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:趋化因子受体引导的B细胞免疫在心血管疾病中的作用
【字体: 大 中 小 】 时间:2025年09月25日 来源:Basic Research in Cardiology 8
编辑推荐:
本综述系统阐述了趋化因子(如CXCL12/CXCR4/ACKR3轴)如何精密调控B细胞(B1与B2亚群)的迁移、定位与功能,进而深度参与动脉粥样硬化(Atherosclerosis)、心肌梗死(MI)及中风等心血管疾病(CVD)的病理进程。文章揭示了B细胞通过分泌天然抗体(如IgM)、细胞因子及调节炎症反应所扮演的双重角色(保护性与致病性),并前瞻性地探讨了靶向特定趋化因子通路(如CXCR5、CCR6)以调控B细胞免疫作为潜在治疗策略的转化前景。
心血管疾病(CVD)是全球首要致死原因,其病理基础广泛涉及动脉粥样硬化(Atherosclerosis)这一慢性炎症性疾病。除经典风险因素外,免疫失调与慢性炎症在CVD中的作用日益凸显。B细胞作为适应性免疫的核心成员,通过抗体分泌与细胞因子释放,在CVD中扮演着双重角色:既可发挥保护作用,亦可能驱动疾病进展。近年来,趋化因子及其受体介导的B细胞迁移、定位与功能调控,已成为理解B细胞在CVD中作用机制的关键。
趋化因子是一类小型分泌蛋白,以其调控免疫细胞趋化运动的能力而闻名。根据其N端半胱氨酸残基的排列方式,可分为CC、CXC、CX3C和XC四个亚家族。它们通过结合经典趋化因子受体(如CXCR4、CXCR5、CCR6等)触发G蛋白偶联的细胞内信号传导,进而调控细胞迁移、存活与分化等过程。
非典型趋化因子受体(ACKRs)则缺乏介导G蛋白激活的关键DRYLAIV基序,因而不能诱导趋化反应,而是作为“诱饵受体”通过内化、清除或呈递配体来间接调控趋化因子的空间分布与丰度。ACKR3(曾用名CXCR7)是CXCL12的高亲和力受体,其表达于特定B细胞亚群(如边缘区B细胞),并通过β-arrestin信号通路参与细胞生存与代谢调节,在心血管病理中具有潜在重要性。
B细胞在骨髓(BM)、次级淋巴器官(SLO)及组织生态位之间的巡弋受到关键趋化因子轴的精密调控。其中,CXCL12-CXCR4与CXCL13-CXCR5信号对B细胞发育、抗原识别及抗体分泌全过程至关重要。例如,CXCL12-CXCR4轴介导浆细胞归巢至骨髓,而CXCL13-CXCR5则参与生发中心(GC)暗区与明区的形成以及B细胞与滤泡树突状细胞(FDC)、T滤泡辅助细胞(Tfh)的相互作用。
B1细胞主要来源于胚胎期肝脏,定居于体腔(如腹膜、胸膜)及血管周围脂肪组织(PVAT)。其迁移至PVAT由CCR6/CCL20轴介导,而向体腔及骨髓的归巢则依赖于CXCR4/CXCL12与CXCR5/CXCL13信号。
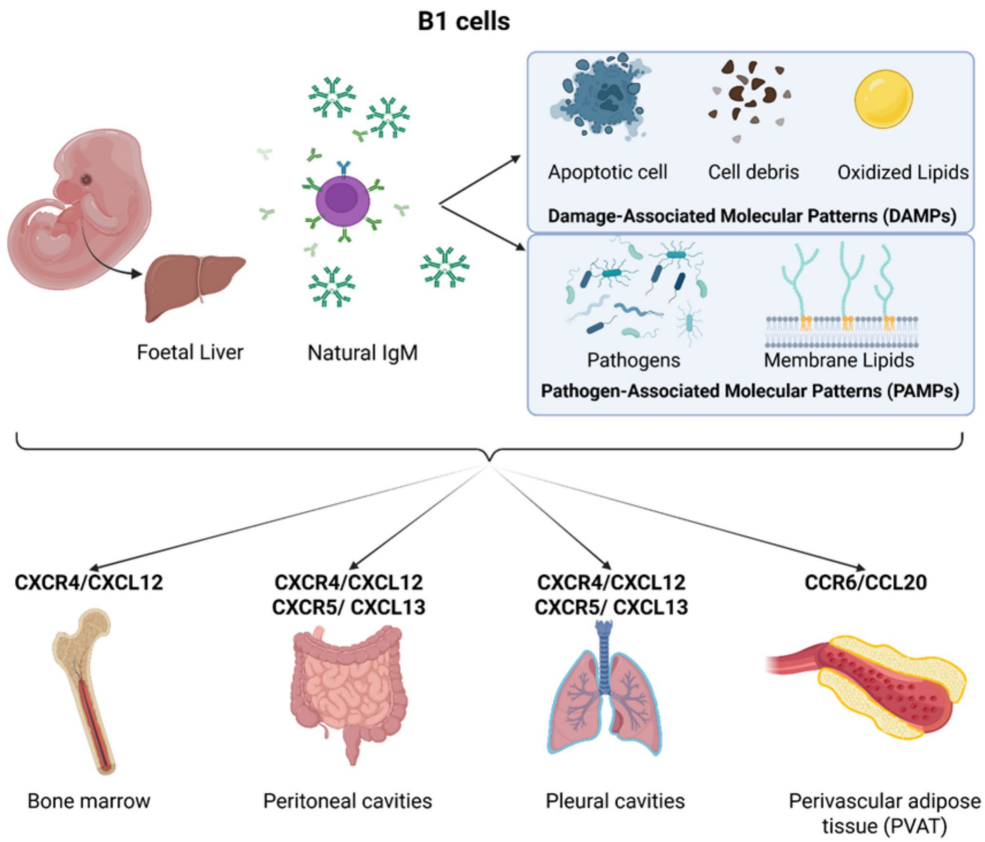
B1细胞是天然抗体(主要为IgM和IgG3)的主要生产者,这些抗体能识别损伤相关分子模式(DAMPs)与病原相关分子模式(PAMPs),在清除氧化脂质、凋亡细胞及病原体中发挥重要作用,从而在动脉粥样硬化中表现出保护效应。例如,PVAT中B1细胞来源的IgM可通过与巨噬细胞相互作用,促进炎症消退与组织稳态。
B2细胞是参与适应性免疫应答的主要B细胞亚群,在骨髓中发育成熟后迁移至脾脏与淋巴结。根据功能与定位,可进一步分为滤泡(FO)B细胞与边缘区(MZ)B细胞。MZ B细胞负责对血源性抗原产生快速、低亲和力的IgM应答;而FO B细胞则介导T细胞依赖的高亲和力抗体生成。
在
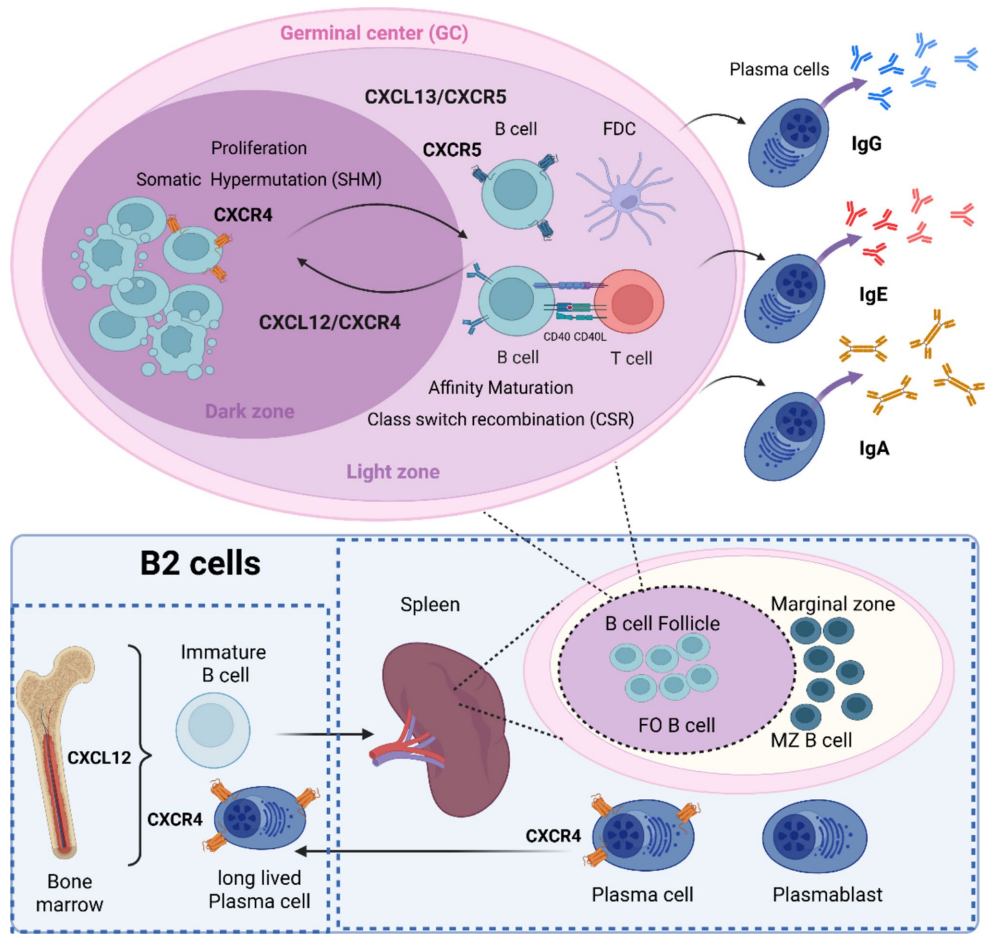
在生发中心反应中,CXCR4/CXCL12与CXCR5/CXCL13梯度共同维持暗区(增殖与体细胞高频突变)与明区(亲和力成熟与类别转换)的空间分隔。成功完成类别转换重组(CSR)与亲和力成熟的B细胞最终分化为记忆B细胞或浆细胞,后者通过上调CXCR4归巢至骨髓并长期存活。
心肌梗死(MI)后,坏死心肌细胞释放DAMPs,触发强烈的炎症反应与免疫细胞浸润。B细胞在此过程中表现出双重作用:成熟B细胞可通过产生CCL7募集中性粒细胞与Ly6Chi单核细胞,加剧炎症并损害心功能;而B1细胞与调节性B细胞(Bregs)则通过分泌IL-10、IL-4及IgM,促进炎症消退与组织修复。
Bregs可通过下调单核细胞CCR2表达,抑制其从骨髓动员与向心脏浸润,从而改善心室重构。此外,CXCR5+CCR7+B细胞亚群在CXCL13引导下迁移至心脏,通过产生TGF-β1参与心肌愈合。
在中风恢复过程中,B细胞通过CXCL13/CXCR5轴浸润脑组织,并分泌脑源性神经营养因子(BDNF)、神经生长因子(NGF)及IL-10等营养因子,发挥神经保护与促进修复的作用。
在动脉粥样硬化中,不同B细胞亚群的作用截然不同:B2细胞(尤其是FO B细胞来源的浆细胞)通过产生促炎性IgG抗体,形成免疫复合物并激活巨噬细胞Fcγ受体,加剧斑块炎症与进展;而B1与MZ B细胞则通过产生天然IgM抗体(如靶向氧化特异性表位的抗oxLDL抗体),促进凋亡细胞清除、抑制泡沫细胞形成,从而发挥保护作用。
趋

趋化因子受体CCR6、CXCR4及ACKR3在调控B细胞定位与功能中扮演关键角色。例如,CCR6缺失会减少PVAT中IgM分泌型B1细胞的募集,局部削弱其保护作用;而B细胞特异性CXCR4缺失则导致骨髓B1细胞减少、血浆IgM水平下降,并加速动脉粥样硬化进展。ACKR3通过调控CXCL12梯度间接影响CXCR4信号,其在人类B细胞亚群(如记忆B细胞与浆母细胞)中的表达提示其可能成为干预新靶点。
靶向趋化因子通路已成为CVD治疗的新兴策略。目前研究较多的靶点包括CCR2(参与单核细胞招募)、CXCR2(中性粒细胞趋化)及CXCR4(干细胞与祖细胞动员)。其中,CXCR4拮抗剂Mavorixafor已被用于WHIM综合征治疗,并正在探索其心血管应用潜力。
针对B细胞相关趋化因子轴的治疗策略尚处于早期阶段。CXCL13中和抗体(如MAb 5261)与CXCR5抑制剂(如PF-06835375)在自身免疫病模型中显示出阻断B细胞与Tfh细胞招募的潜力,为动脉粥样硬化及心肌炎治疗提供了新思路。此外,抗CD20介导的B细胞清除(如利妥昔单抗)在急性心肌梗死患者中的初步研究显示其安全性良好,且可能通过抑制CCL7产生与单核细胞动员改善心室重构。
趋化因子受体引导的B细胞免疫在CVD中具有复杂而关键的调控作用。尽管现有证据主要来源于小鼠模型,但人类研究同样提示CXCR4/CXCL12/ACKR3轴在B细胞迁移与抗体产生中的保守性。未来研究需进一步阐明ACKR3在人类B细胞中的作用,并探索靶向特定趋化因子通路以选择性增强保护性B细胞反应(如B1细胞来源的IgM)同时抑制致病性应答(如促炎性IgG产生)的治疗策略。通过结合精准免疫表型分析、生物标志物引导的患者分层及纳米靶向递送技术,趋化因子导向的免疫调控有望为CVD治疗开辟新途径。
 生物通微信公众号
生物通微信公众号
知名企业招聘