
-

生物通官微
陪你抓住生命科技
跳动的脉搏
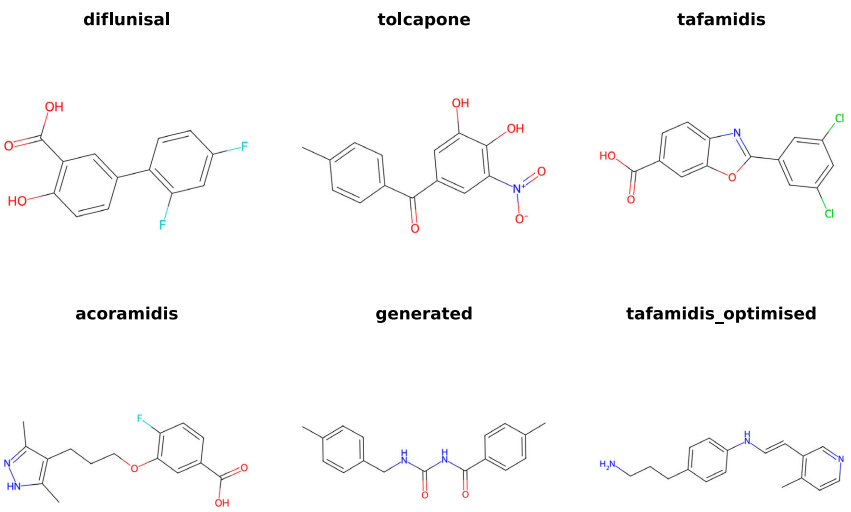
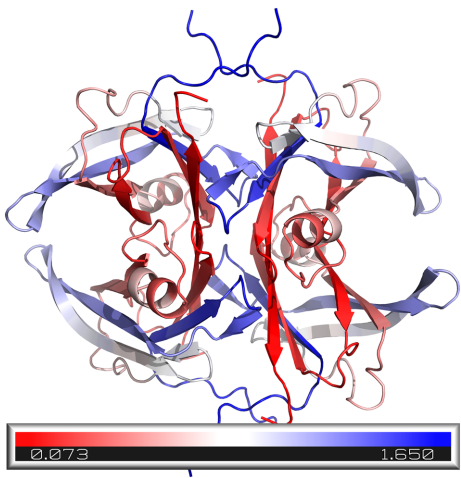
整合结构解析与配体优化:跨越甲状腺素运载蛋白突变谱系的精准治疗新策略
【字体: 大 中 小 】 时间:2025年09月26日 来源:npj Systems Biology and Applications 3.5
编辑推荐:
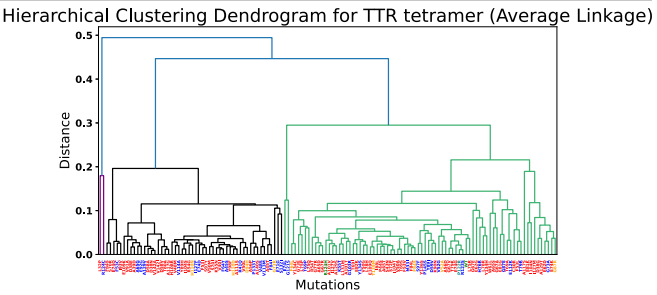
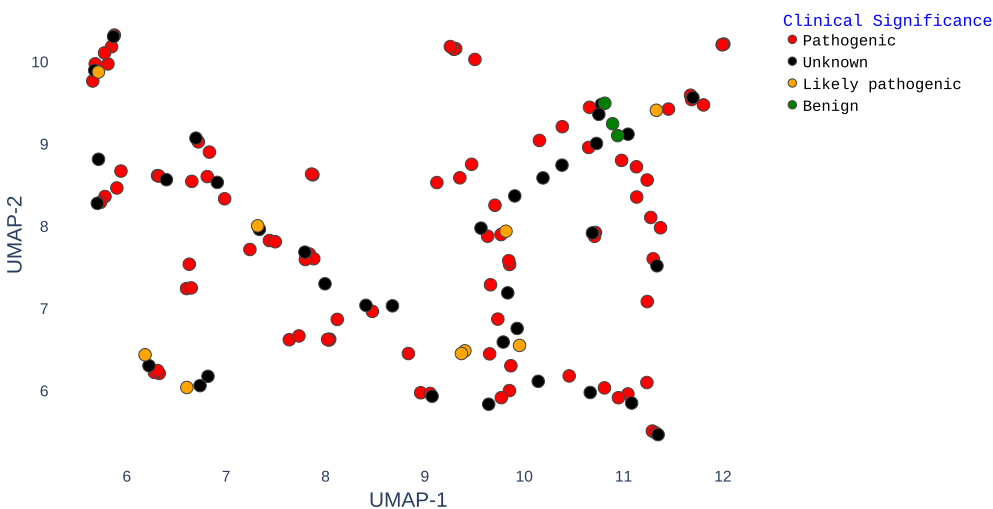
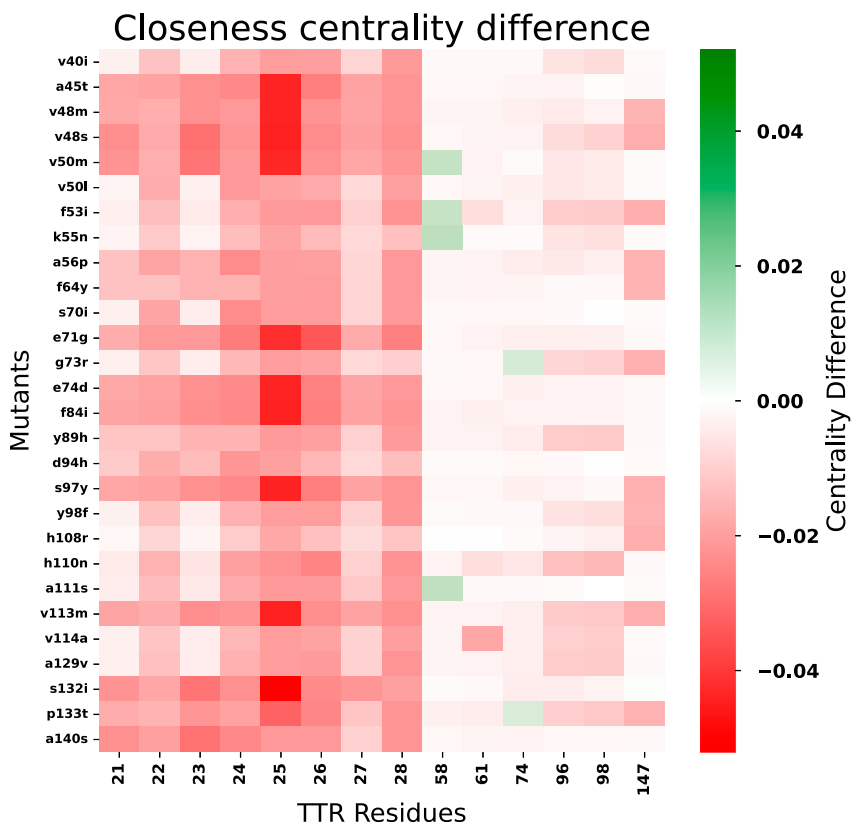
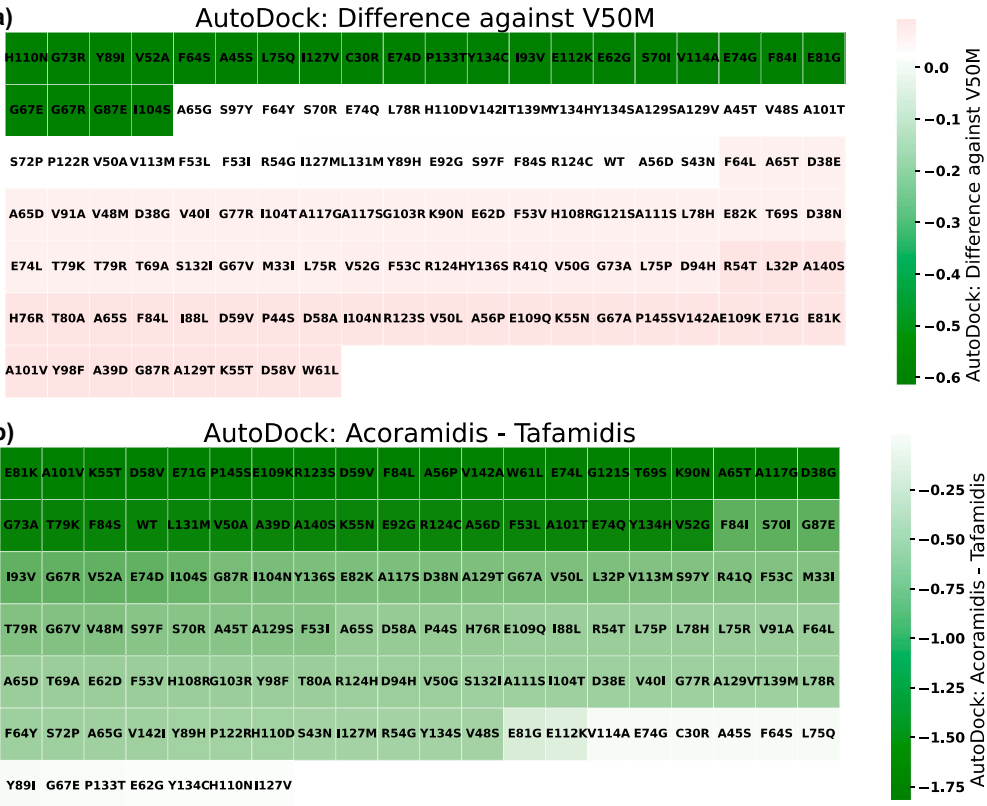
本研究针对甲状腺素运载蛋白淀粉样变性(ATTR)中不同TTR突变对稳定剂(如tafamidis和acoramidis)响应差异的难题,开发了结合AlphaFold3、ESM2、DiffDock-L和DiffSBDD的计算生物学流程,揭示了突变特异性结合模式,并通过生成式设计获得变异感知配体,为ATTR的精准药物设计提供了新范式。
 生物通微信公众号
生物通微信公众号
知名企业招聘