
-

生物通官微
陪你抓住生命科技
跳动的脉搏
氧化还原调控PD-1/PD-L1/PD-L2相互作用的分子动力学研究及其对癌症免疫治疗的启示
【字体: 大 中 小 】 时间:2025年09月26日 来源:Scientific Reports 3.9
编辑推荐:
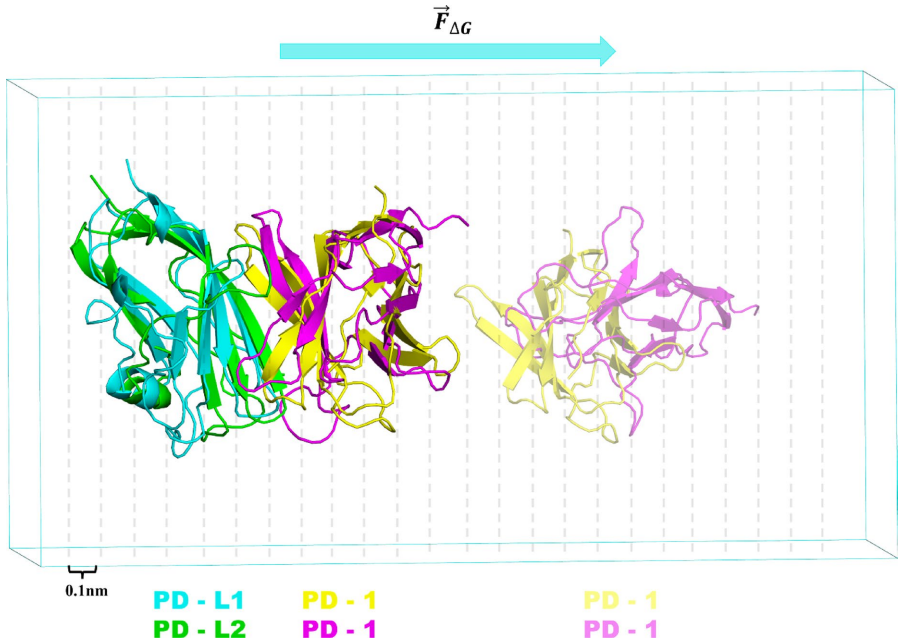
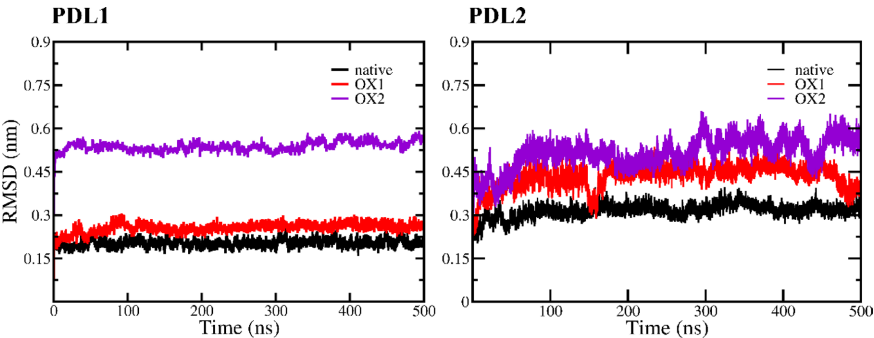
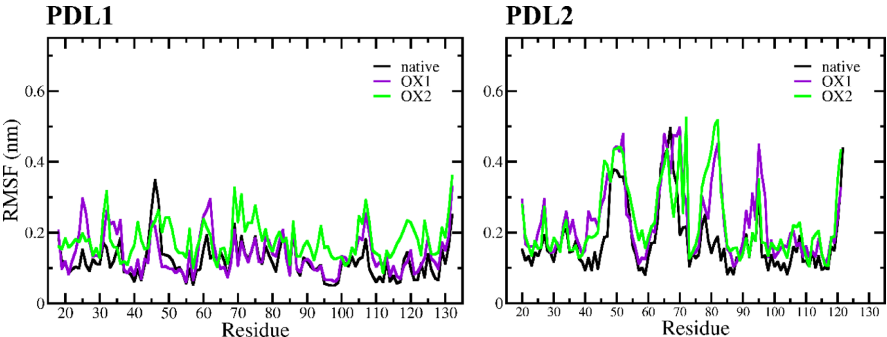
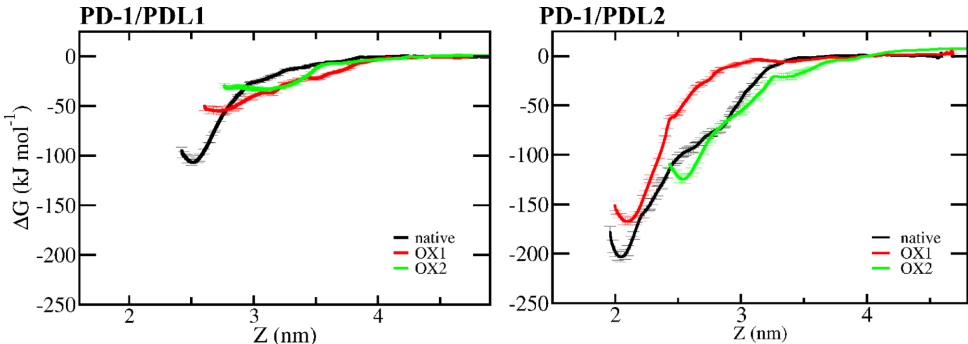
本刊推荐:为探索冷大气等离子体(CAP)对免疫检查点蛋白(ICPs)的调控机制,研究人员通过分子动力学(MD)模拟和增强采样技术,系统研究了CAP诱导氧化对PD-1/PD-L1及PD-1/PD-L2相互作用的分子机制。研究发现氧化作用显著降低PD-1与配体的结合亲和力,为CAP通过调控免疫检查点增强抗肿瘤免疫提供了理论依据,对开发新型癌症免疫治疗策略具有重要意义。
 生物通微信公众号
生物通微信公众号
知名企业招聘