
-

生物通官微
陪你抓住生命科技
跳动的脉搏
整合转录组与表观基因组数据挖掘妊娠期糖尿病新型诊断标志物与治疗靶点
【字体: 大 中 小 】 时间:2025年09月26日 来源:Scientific Reports 3.9
编辑推荐:
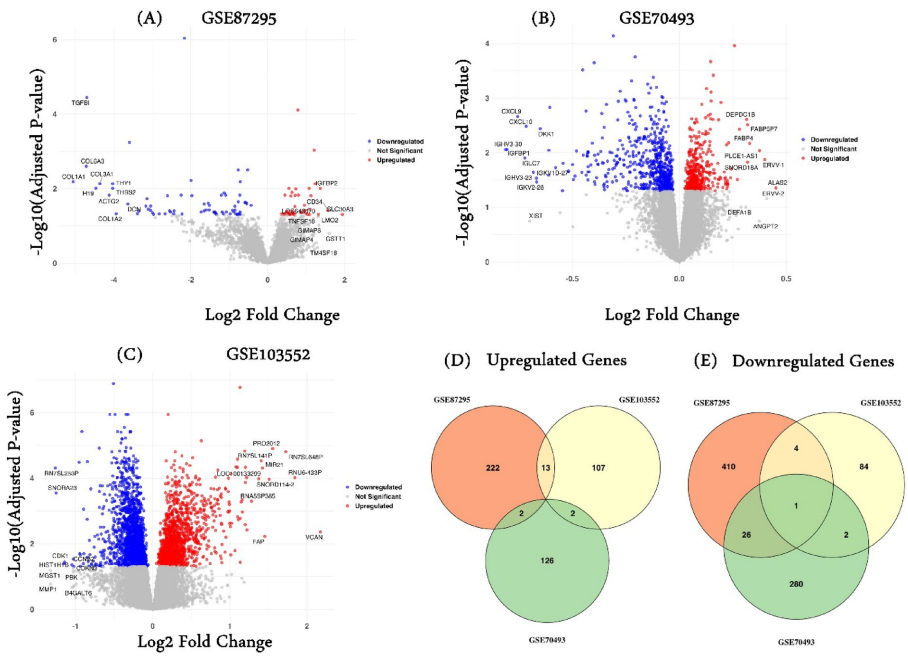
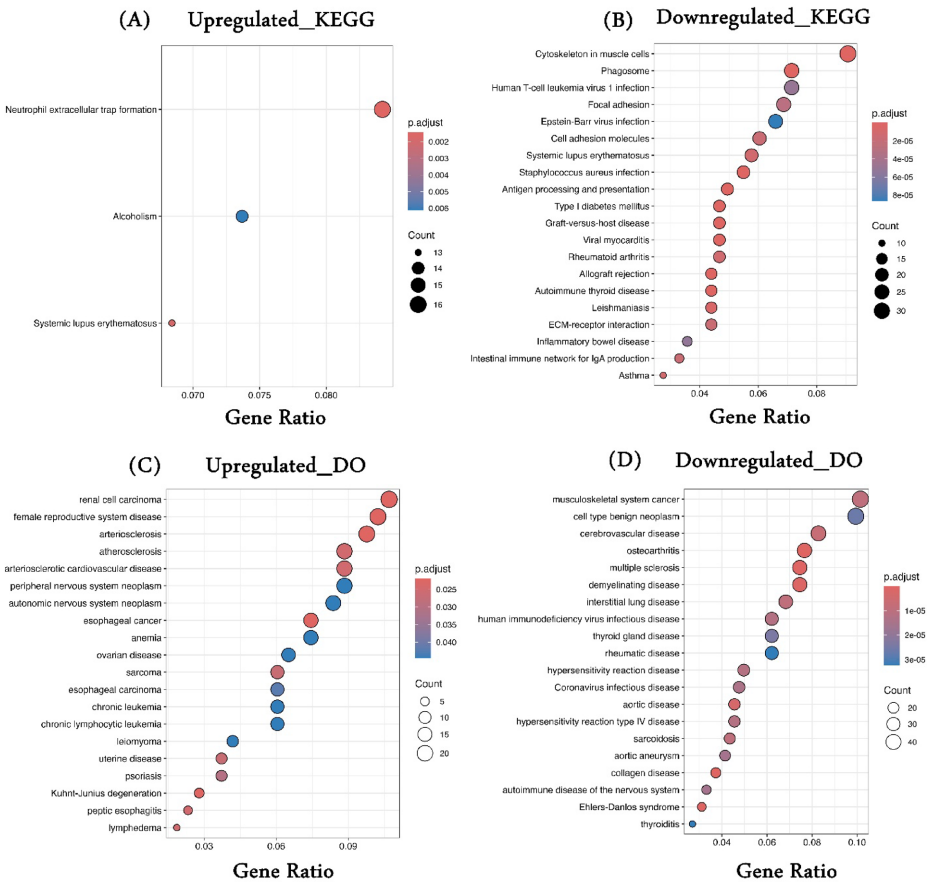
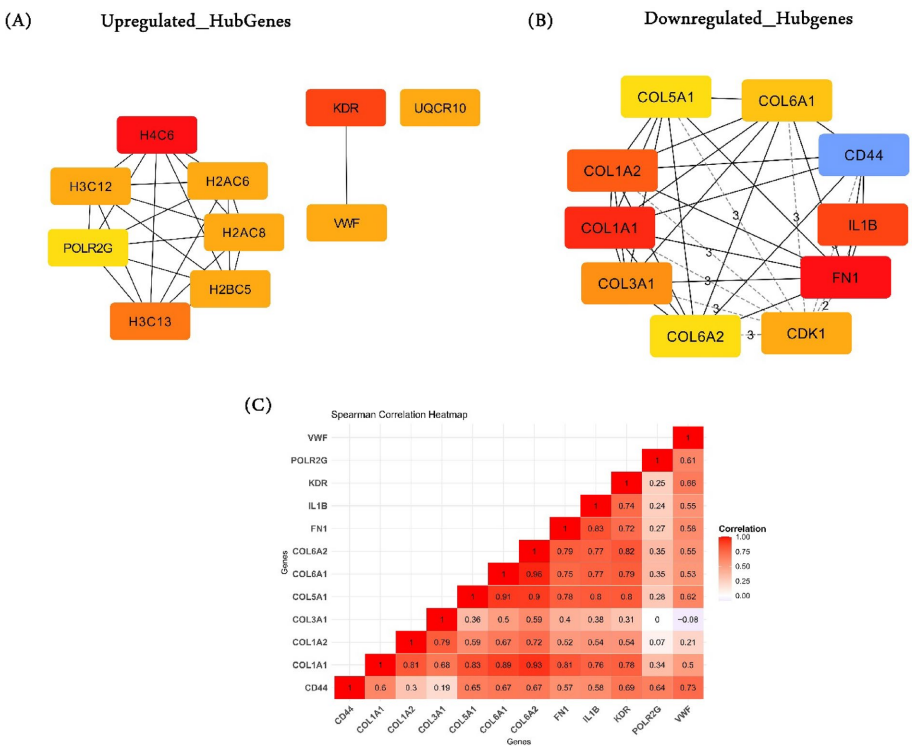
本研究针对妊娠期糖尿病(GDM)诊断和治疗瓶颈,通过整合多组学数据揭示分子机制。研究人员分析3个转录组数据集,鉴定1234个差异表达基因,结合DNA甲基化谱筛选出11个关键基因。免疫浸润分析发现记忆B细胞升高、M1巨噬细胞和CD8+T细胞降低的现象。通过蛋白互作网络和ROC曲线验证了7个核心基因(POLR2G、VWF等)的诊断价值,为GDM精准诊疗提供新方向。




 生物通微信公众号
生物通微信公众号
知名企业招聘