
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CD103-CD8+ T细胞通过Granzyme K-PAR-1信号通路促进阿尔茨海默病神经毒性炎症
【字体: 大 中 小 】 时间:2025年09月26日 来源:Nature Communications 15.7
编辑推荐:
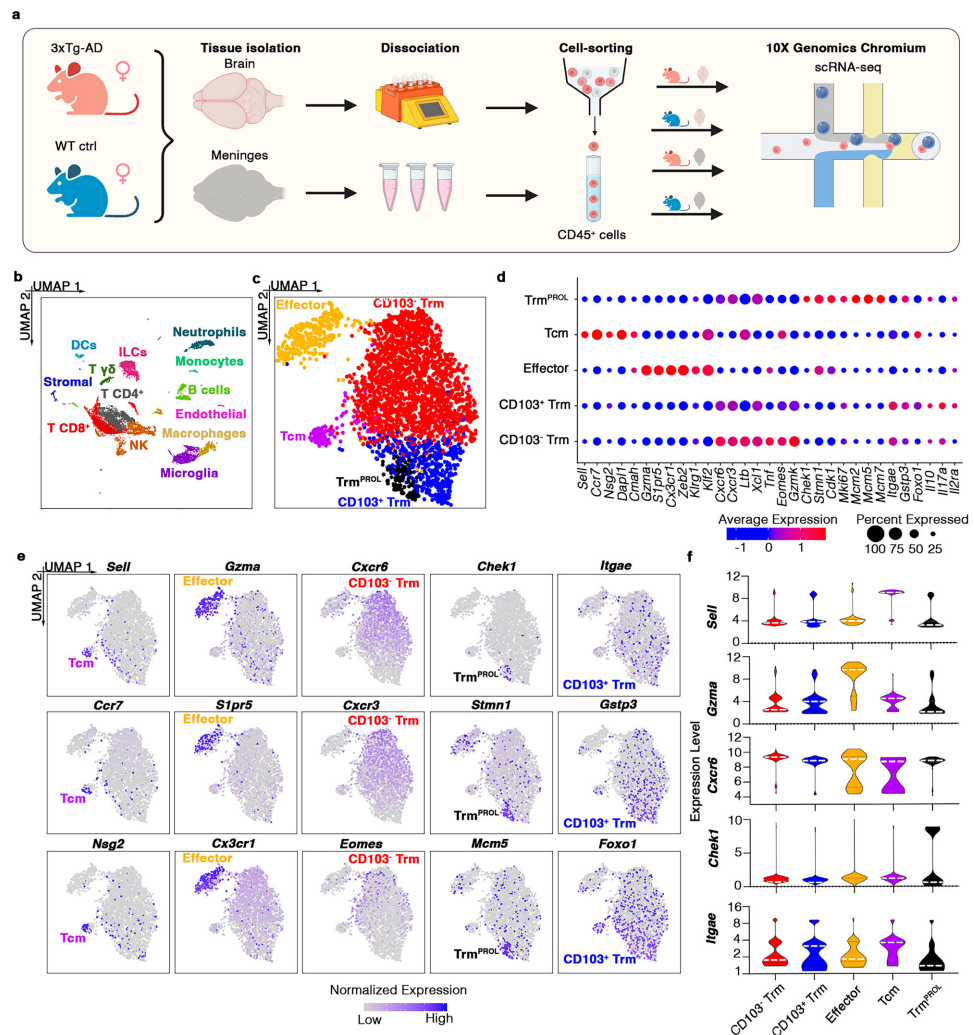
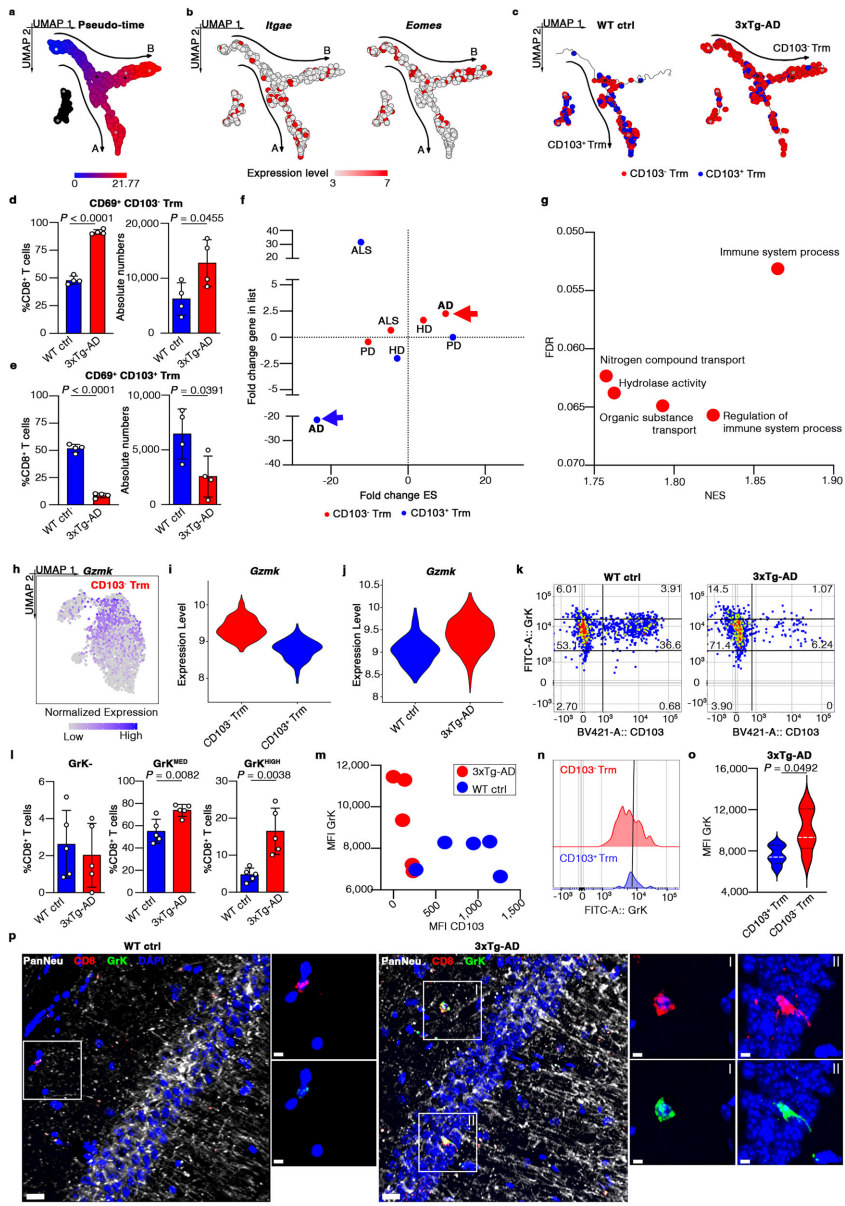
本研究揭示了阿尔茨海默病(AD)中CD103-CD8+组织驻留记忆T细胞(Trm)通过Granzyme K(GrK)-蛋白酶激活受体1(PAR-1)信号轴诱导神经元功能障碍和tau蛋白过度磷酸化的新机制。研究人员发现该细胞亚群通过LFA-1整合素介导的迁移途径从外周循环浸润大脑,其产生的GrK通过激活神经元PAR-1受体引发钙信号紊乱。该研究为AD免疫治疗提供了新的靶点,发表于《Nature Communications》。



 生物通微信公众号
生物通微信公众号
知名企业招聘