
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:微生物组在遗传中的作用:母体微生物组传递如何影响下一代健康
【字体: 大 中 小 】 时间:2025年09月27日 来源:Microbiome 12.7
编辑推荐:
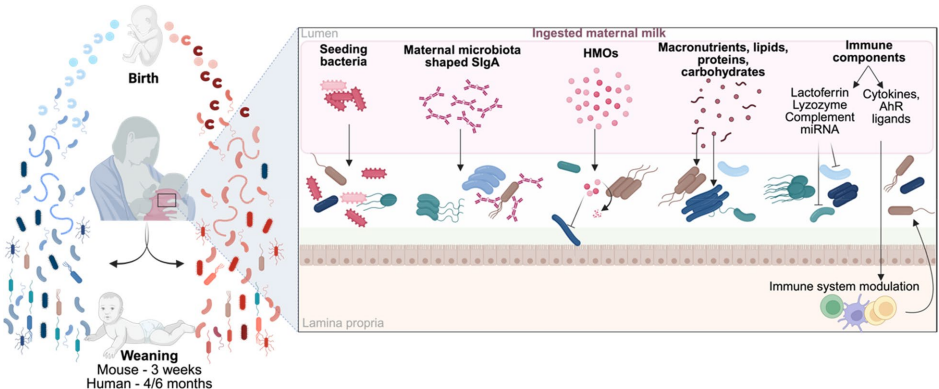
本综述系统阐述了母体微生物组通过垂直传递与母乳成分(如HMOs、SIgA)塑造子代早期肠道菌群的关键机制,揭示了生命早期"机会窗口"对免疫耐受(TREG细胞)建立的重要性。作者强调现代饮食(乳化剂/高脂/低纤维)导致的母体微生态紊乱可能通过TLR/MyD88信号通路加剧子代对炎症性肠病(IBD)、肥胖等非传染性疾病(NCDs)的易感性,为营养干预提供理论依据。


 生物通微信公众号
生物通微信公众号
知名企业招聘