
-

生物通官微
陪你抓住生命科技
跳动的脉搏
CD19+CD24hiCD38hi调节性B细胞在类风湿关节炎中的关键作用:疾病活动度与治疗响应的新生物标志物
【字体: 大 中 小 】 时间:2025年09月27日 来源:Advances in Rheumatology 2.1
编辑推荐:
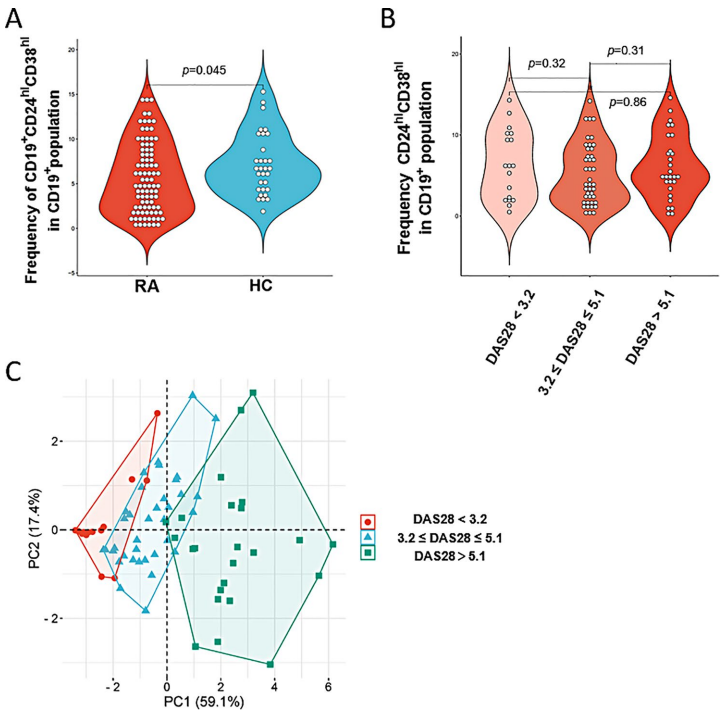
本刊推荐:研究团队针对类风湿关节炎(RA)免疫调控机制未明的临床问题,开展了CD19+CD24hiCD38hi调节性B细胞(Bregs)与疾病活动度关联性的研究。通过前瞻性队列分析发现RA患者Bregs水平显著低于健康人群(降低10.51%),且与晨僵时间、年龄及抗-CCP抗体滴度具显著相关性。治疗6个月后Bregs水平随疾病活动度下降而显著回升,证实其可作为评估RA治疗响应的动态生物标志物,为靶向免疫调节治疗提供新方向。



 生物通微信公众号
生物通微信公众号
知名企业招聘