
-

生物通官微
陪你抓住生命科技
跳动的脉搏
综述:硒与硒蛋白在中性粒细胞功能中的作用
【字体: 大 中 小 】 时间:2025年09月27日 来源:Biological Trace Element Research 3.6
编辑推荐:
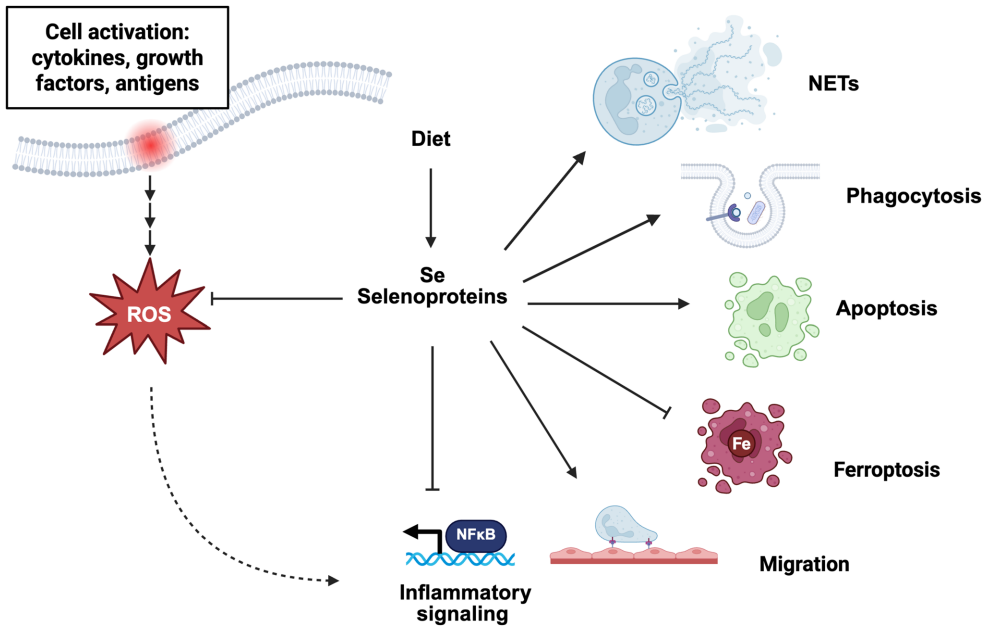
本综述系统阐述了必需微量元素硒及其功能性形式硒蛋白在中性粒细胞(先天免疫关键效应细胞)中的多维调控作用。文章聚焦于活性氧(ROS)的核心地位,详细解析了硒/硒蛋白如何通过调节NADPH氧化酶(NOX)复合物、脂质介质(如LTB4、12-HETE)代谢、炎症信号通路(NF-κB、NLRP3 inflammasome)及细胞死亡方式(凋亡、ferroptosis),进而精细调控中性粒细胞的趋化、吞噬、NETs形成、炎症因子释放及凋亡等关键功能,为相关炎症性疾病(如IBD、RA)的机制研究与靶向干预提供了新的视角。

 生物通微信公众号
生物通微信公众号
知名企业招聘