
-

生物通官微
陪你抓住生命科技
跳动的脉搏
基于共聚焦拉曼显微镜的细胞内代谢互作原位半定量成像技术揭示深海贻贝内共生机制
【字体: 大 中 小 】 时间:2025年09月27日 来源:iScience 4.1
编辑推荐:
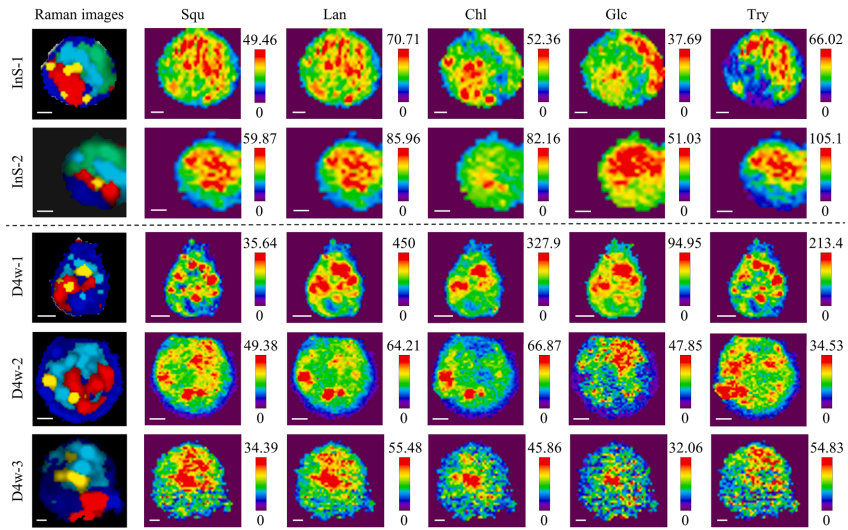
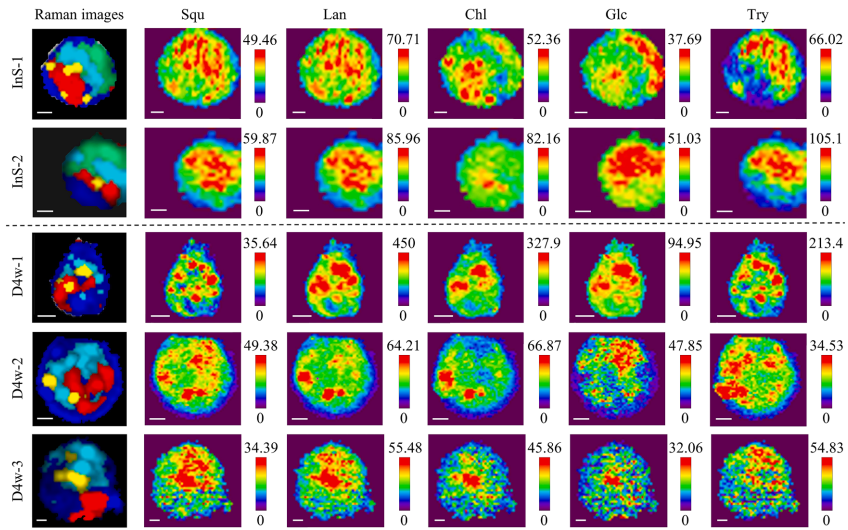
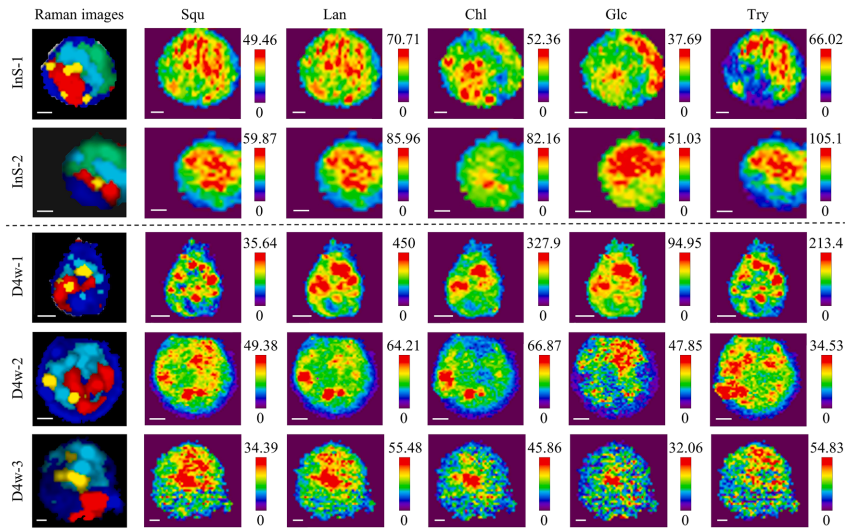
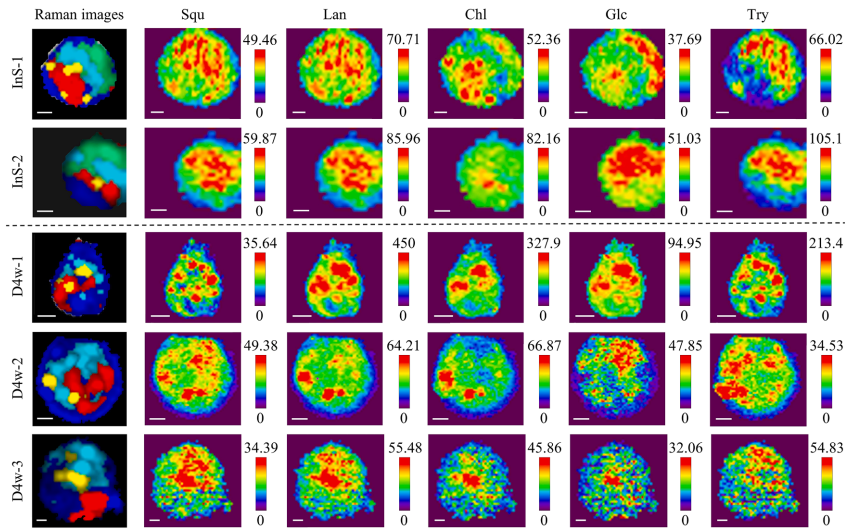
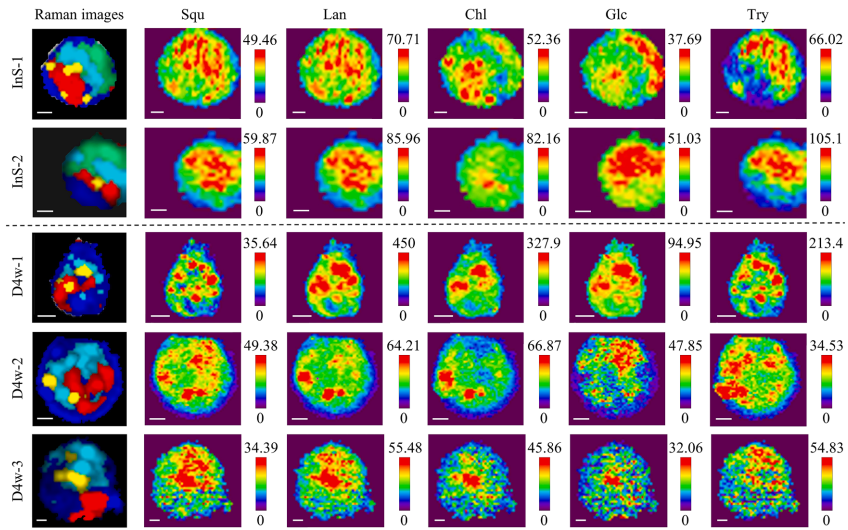
本研究针对深海贻贝-甲烷氧化菌内共生系统中代谢互作机制难以解析的难题,开发了基于内标法的多变量半定量成像方法,通过共聚焦拉曼显微镜(CRM)实现了多种代谢物的同步亚细胞分布解析。研究发现共生菌株存在基于糖原丰度的生态位驱动代谢策略分化,并首次提供共生菌可能为宿主提供胆固醇合成中间体的直接证据,为研究不可培养微生物的代谢互作提供了强大的非侵入性工具。
 生物通微信公众号
生物通微信公众号
知名企业招聘