
-

生物通官微
陪你抓住生命科技
跳动的脉搏
衰老小鼠流感病毒感染中I型干扰素早期应答受损导致后期肺部炎症加剧的机制研究
【字体: 大 中 小 】 时间:2025年09月27日 来源:GeroScience 5.4
编辑推荐:
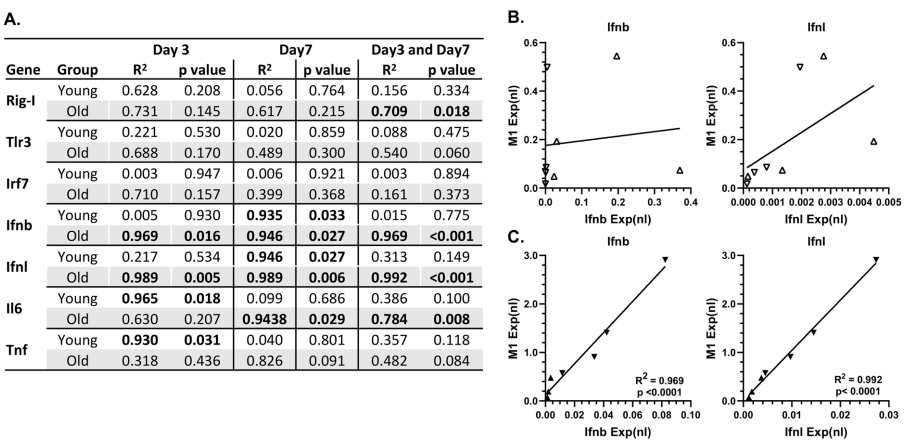
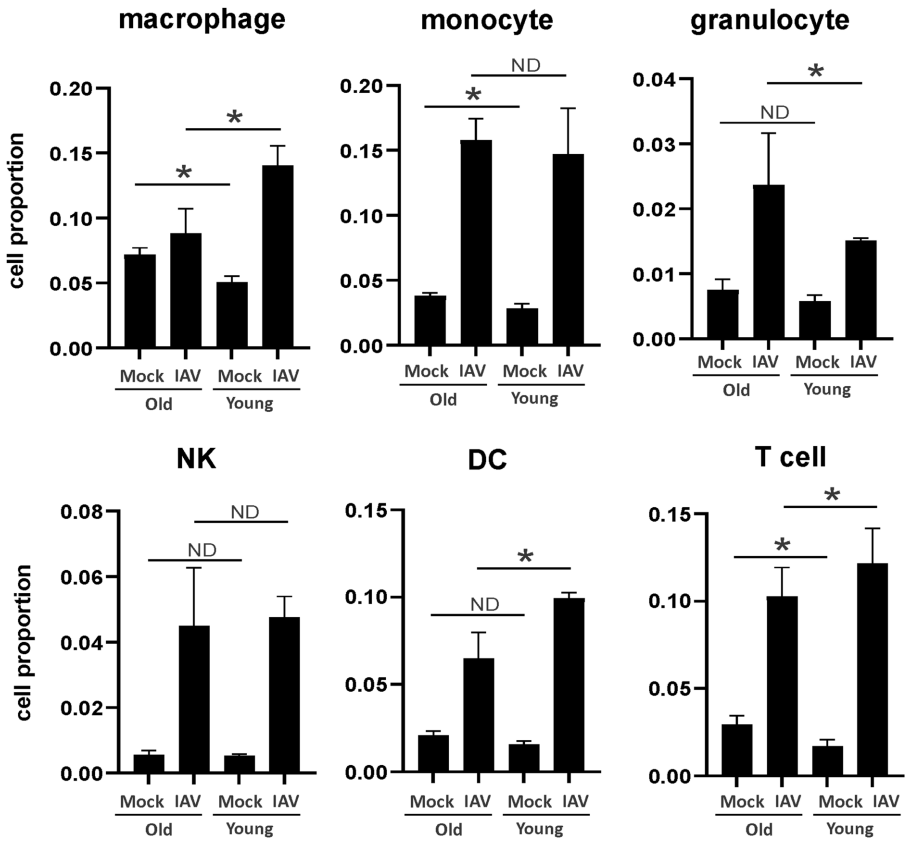
本研究针对老年群体流感高死亡率问题,通过对比年轻与老年小鼠流感病毒感染模型,发现老年个体早期I型干扰素(IFN-β)应答缺陷导致病毒清除延迟,而III型干扰素(IFN-λ)代偿性高表达反而加剧后期肺部炎症。单细胞测序技术揭示老年小鼠肺部巨噬细胞M1极化倾向和Rgs1基因特异性高表达,为老年流感重症化机制提供了新的治疗靶点。研究成果对改善老年流感临床预后具有重要指导意义。

 生物通微信公众号
生物通微信公众号
知名企业招聘