
-

生物通官微
陪你抓住生命科技
跳动的脉搏
突破传统:Cytation多模式平台在光敏剂抗氧化活性检测中的新应用
【字体: 大 中 小 】 时间:2025年09月22日 来源:安捷伦BioTek
编辑推荐:
目前唯一在细胞模型上使用的ROS生物传感器是二氯二氢荧光素二乙酸酯(DCFH-DA),但是使用该方法也有很多局限性,比如无法区分抗氧化性和细胞毒性等;而采用全新AOP1光激活细胞系统(Light Up cell System,LUCS)技术,能够很好地弥补这一缺憾,在活细胞水平精细检测ROS的产生。
AOP1光激活细胞系统技术用于天然抗氧化物筛选
自然界赋予了植物丰富的抗氧化资源,长久以来,学术界及工业界都在不懈地从这些绿色宝藏中寻找能够对抗自由基损伤、延缓衰老甚至治疗疾病的“圣杯”。然而,大多数现有的评价体系基于试管内生化水平的检测,无法准确反映活体或者活细胞条件下抗氧化剂的真实效能。目前唯一在细胞模型上使用的ROS生物传感器是二氯二氢荧光素二乙酸酯(DCFH-DA),但是使用该方法也有很多局限性,比如无法区分抗氧化性和细胞毒性等;而采用全新AOP1光激活细胞系统(Light Up cell System,LUCS)技术,能够很好地弥补这一缺憾,在活细胞水平精细检测ROS的产生。
什么是AOP1技术
AOP1检测方法基于一种光激活光敏剂噻唑橙(Thiazole orange,TO),它能够释放与细胞产生的ROS的实际浓度相关的信号。检测原理如下图1所示:(1) 光诱导前,噻唑橙(TO)加入细胞后被外排转运蛋白排出细胞;(2) 光照下,TO将能量转移给三重态的分子氧,生成单线态氧和自由基(ROS) (3) ROS改变TO的外排和其他细胞功能;4) TO进入细胞核后增加荧光发射信号强度。加入抗氧化剂后,抗氧化剂抑制ROS的产生, 保持TO在细胞外从而降低荧光信号,通过这个原理可以用于筛选评价抗氧化药物的作用效果。
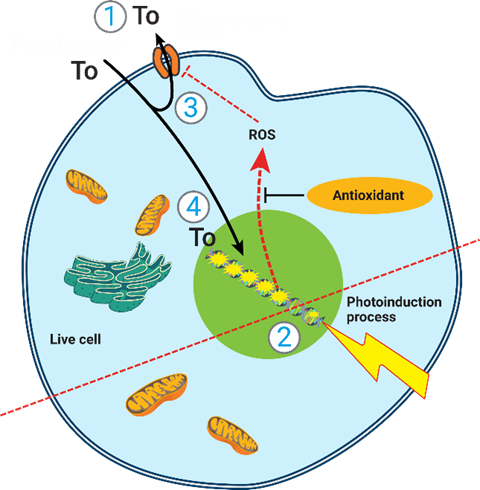
图1:AOP1检测原理示意图
如何开展AOP1的检测?
对于光敏剂的检测,传统的方法,需要外部光源提供持续高能光照闪烁以实现光诱导,并没有合适的设别开展针对光敏剂的微孔板体系的高通量检测,而安捷伦BioTek Cytation 5多模式细胞成像系统具有独特的显微成像和微孔板读数双平台,可以在一台设备内为微孔板样品提供基于LED灯的光源照射,以及基于高能氙灯的荧光强度检测。正因为这样灵巧的设计,能够让用于以“即插即用”模式实现便捷的AOP1高通量检测(图2)。
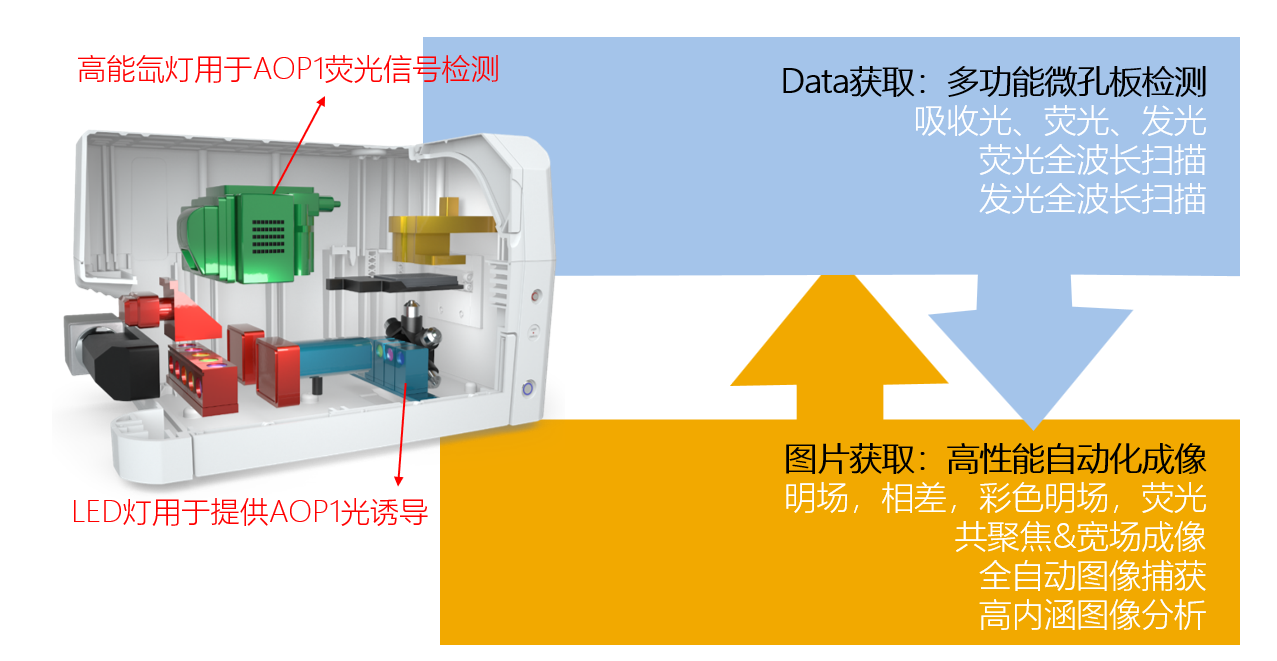
图2:Cytation系列产品的巧妙设计用于支持AOP1检测
AOP1活细胞水平评价抗氧化物活性案例
我们用一个小案例来展示使用Cytation多模式平台开展活细胞水平的抗氧化活性评价,本实验采用HepG2细胞系进行检测,细胞在37°C、5% CO2下培养,并转移到96孔微孔板中。试验方案中加入不同浓度的槲皮素(1.95至500微摩尔)药物处理4小时候,将AOP1检测试剂盒(编号K-1001,来自Anti Oxidant Power)的溶液A添加到待测样本孔中,在37℃,5% CO2中孵育30分钟。孵育后,采用Cytation5平台的两步法,每2分钟动态测量一次AOP1的荧光信号强度。
Cytation5 & Gen5 设置AOP1检测程序
Gen5软件采用Agilent BioTek特有的StepWise程序编辑流程,能够灵活的将多功能微孔板检测步骤和荧光显微成像步骤灵活的组合在一次实验程序设置中,正由于这个优势,可以非常便捷的通过两步法,实现AOP1的抗氧化能力测定(图3)。
Step1: 使用505nm激发和535nm发射波长测量AOP1初始荧光强度
Step2: 设计动力学读数模块,立即用Cytation 5成像模式的GFP LED光源,在强度1的条件下照射500毫秒。这个荧光读数/照明周期设置为重复相同的18次重复,用于获得动力学读数曲线。
如果需要,还可以使用Cytation5的无标记成像模式对孔板内的细胞进行计数,用于结果的均一化,获得更可靠的数据。
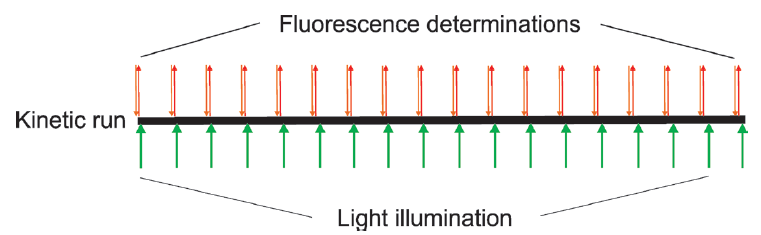
图3:Cytation5 & Gen5 AOP1检测流程示意图
数据分析
细胞抗氧化指数,Cellular antioxidant index (CAI)的计算采用每个样品标准化后的动力学曲线积分结果,计算公式CAI = 1000 - (X ∙ 1000) CTL,其中X是X是标准化的相对荧光强度(RFU),CTL是标准化对照孔的平均值。计算CAI值后,采用非线性回归模型(Sigmoid拟合)计算EC50值。
实验结果
使用Cytation5的两步法AOP1检测,能够动态监测TO荧光的变化。这些数据可以被标准化,以便更容易地在实验之间进行比较,如图4所示。TO浓度的轻微差异、细胞数量的不同以及细胞类型的差异都可能导致原始荧光信号的变化。每次荧光动力学测定的结果都归一化为未处理对照组最后一次动力学测定的平均值(假定这是最高的原始信号),并表示为百分比。这种分析方法可以用于比较不同实验中对照样本与实验样本之间ROS活性抑制的时间或程度。
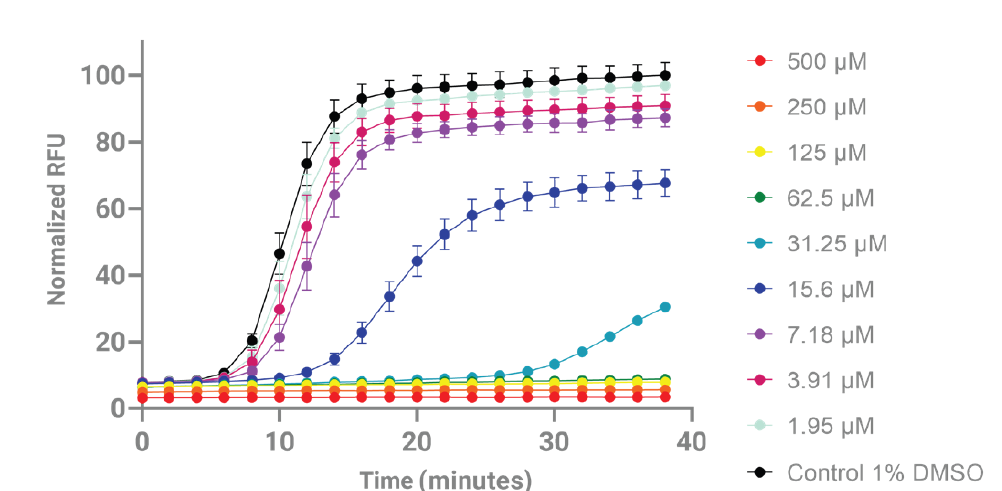
图4:将荧光数据绘制为时间的函数。用归一化积分计算细胞抗氧化指数(CAI)。
归一化后的数据可以在测量后进一步分析,通过计算数据曲线下的面积(AUC)或数据的积分,可以为每个处理浓度计算一个CAI值。这些数据可以用四参数拟合确定EC50值。图5展示了两次独立的槲皮素EC50值的测定。
从结果看,槲皮素的EC50值分别在两块不同的板上测定为15.70和15.78 μM,相关系数(R2)分别为0.996和0.994,这些数据展示了使用Cytation平台开展AOP1实验的可靠性和重复性,这些结果与先前发表的数据(槲皮素EC50 = 23.66 μM,R2 = 0.985)一致。
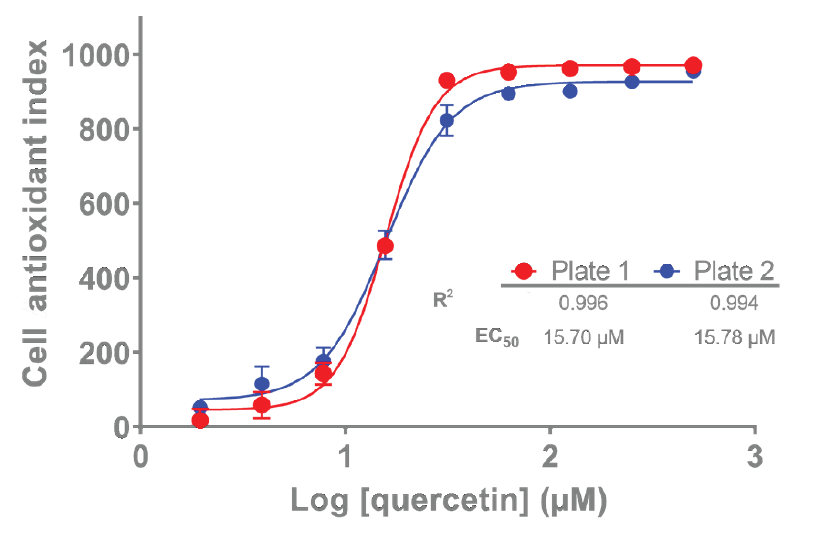
图5:计算化合物剂量效应曲线,并计算EC50用于对比不同化合物的作用效果
Cytation平台开展AOP1抗氧化活性评价检测的优势:打破传统,化繁为简,性能优异,无限拓展
由于AOP1检测需要高强度的光线来实现光激活,并且需要动力学读数检测,此前AOP1这类光敏剂的实验的数据是使用专门的闪光灯照射器获得,并且操作起来相当繁琐,每次进行光照时,都需要将微孔板从读板机中取出,并手动移动到光源处。然而,Cytation 系列的巧妙设计能够同时进行显微荧光成像和传统的荧光强度检测,显微成像模块提供了一个聚焦的、特定波长的、高能量的光线来激发荧光分子,开展AOP1检测时无需反复取出样本,为AOP1检测提供了全新的方案。
此外Cytation系列平台支持高通量检测,可配置完善的活细胞检测装置,适用于96孔和384孔微孔板中的贴壁细胞和悬浮细胞,适合高通量抗氧化物的筛选方案,其出色的多模式平台还可以用于后续的药物靶点及毒性评价相关实验的开展。
全面而灵活:Agilent BioTek Cytation 系列细胞成像多功能微孔板检测系统