
-

生物通官微
陪你抓住生命科技
跳动的脉搏
一文读懂批量细胞与单细胞测序的本质区别
【字体: 大 中 小 】 时间:2026年01月06日 来源:10x Genomics
编辑推荐:
阅读本文,了解这两种研究基因表达的方法——批量细胞RNA测序和单细胞RNA测序,它们各自的优缺点,以及单细胞RNA测序如何影响重要研究领域,让我们对生物复杂性和疾病的认知有了突破。
单细胞测序的出现让科学家能够定义细胞类型特异性的基因表达和多组学读数,并解析细胞异质性,正是这种异质性驱动了在批量细胞RNA-seq中观察到的表达模式。
阅读本文,了解这两种研究基因表达的方法——批量细胞RNA测序和单细胞RNA测序,它们各自的优缺点,以及单细胞RNA测序如何影响重要研究领域,让我们对生物复杂性和疾病的认知有了突破。
研究基因表达的不同方法:批量细胞 vs. 单细胞RNA-seq
目前有两种主要方法来检测复杂生物样本中细胞的基因表达水平:批量细胞RNA测序(bulk RNA-seq)和单细胞RNA测序(scRNA-seq)。为了解每种方法的优势和限制,我们先来厘清它们的定义和差异。
1. 批量细胞RNA-seq是什么?
批量细胞RNA-seq是一种基于新一代测序(NGS)的方法,可测定一群细胞的全转录组。这种方法是基于整个群体的,这意味着它提供整个样本的基因表达读数,其中多种不同细胞混合在一起,对该图谱有贡献。这是一种平均读数,也就是说它提供单个基因在构成样本的所有细胞中的平均表达水平。
批量细胞实验中的步骤
在批量细胞RNA-seq工作流程中,首先是对生物样本进行消化以提取RNA。可提取样本中的总RNA,也可以采用特定步骤来富集mRNA或去除核糖体RNA。随后将RNA转化成cDNA,并经过后续处理步骤制备出可直接测序的基因表达文库。在完成测序和数据分析后,您可以查看组织样本的基因表达水平。
2. 单细胞RNA-seq是什么?
单细胞RNA测序(scRNA-seq)是一种研究样本中每个细胞的全转录组基因表达谱的方法。若将批量分析的读数比作观看森林全貌,那么单细胞读数就像观察每棵树木。因此,两者之间存在一些关键的实验差异,我们将在下文中介绍。
单细胞RNA-seq的样本制备
scRNA-seq的测量结果来自单个细胞,而非细胞混合物。首先通过酶解或机械处理、细胞分选或其他细胞分离技术,将完整样本制备成单细胞悬液。随后进行细胞计数和质量控制,确保样本中含有适当浓度的活细胞,且不含细胞团块和碎片。
如有必要,可使用抗体对样本进行染色,以标记蛋白质及其他生物分析物,或通过FACS技术富集感兴趣的细胞类型。
样本解离步骤因起始材料和实验目标而异。有时需要额外的制备步骤,具体取决于组织质量、样本丰度、细胞大小,或需要提取细胞核进行染色质可及性分析。尽管具体的考虑因素不同,但生成高质量单细胞悬液的基本原则适用于所有样本类型。
仪器辅助的细胞微滴生成
与批量细胞RNA-seq相同,单细胞RNA-seq的目标也是分离出RNA并将其转化成cDNA,通过新一代测序来测定整个转录组的基因表达水平。在10x Genomics的scRNA-seq工作流程中,单个细胞被分离至独立的微反应容器(Gel Beads-in-emulsion/GEMs)中进行RNA分离。这个微滴生成步骤发生在Chromium X系列仪器搭载的微流控芯片内,是在自动化的受控环境下完成的。
随后在GEM内,凝胶珠被溶解,释放出独特条形码标记的寡核苷酸。同时细胞被裂解,让RNA得以捕获并用细胞特异性的条形码标记。这确保每个细胞的分析物可追溯至其来源细胞。然后利用标记后的产物构建测序文库,进而对每个细胞完整转录组的基因表达水平进行测定。
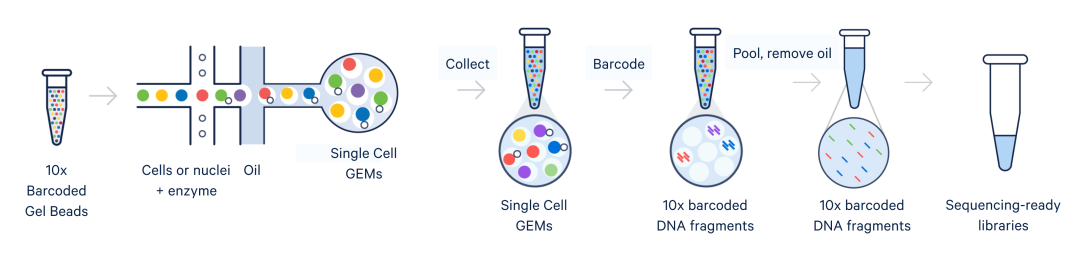
图1. 这张示意图展示了细胞或细胞核沿着Chromium X系列仪器内的微流控通道移动并生成GEM。这是单细胞实验流程中的一部分,能够生成可直接测序的基因表达文库。
3. 批量细胞RNA-seq的应用
由于批量分析的读数让人能够从整体上了解样本的平均基因表达谱,该方法的主要应用场景(1)包括:
差异基因表达分析:通过比较不同实验条件(比如疾病与健康、处理组与对照组、不同发育阶段或时间进程实验)下的批量细胞基因表达谱,您能够鉴定在这些条件下上调或下调的基因。它还支持以下应用:
a. 发现RNA生物标志物和分子特征,用于疾病诊断、预后或分层
b. 探究基因组合(通路和网络)如何在不同生物条件下协同变化
组织或群体水平的转录组学研究:批量分析的数据有助于获取完整组织、器官或批量分选细胞群体的整体表达谱。这种群体水平的分析适用于:
a. 大型队列研究或生物样本库项目
b. 为新发现或研究较少的生物体或组织提供基线转录组图谱
c. 支持单细胞RNA测序参考图谱的解卷积研究
鉴定和表征新转录本:批量分析的数据可用于异构体、非编码RNA、可变剪接事件以及基因融合的注释。
4. 单细胞RNA-seq的应用
有了单细胞基因表达读数,您能够解析异质性样本中更深层次的生物复杂性,包括梳理罕见或低丰度的细胞类型和细胞状态,并揭示细胞功能和分化背后的机制。
单细胞方法的主要应用场景以及可回答的问题包括:
表征异质性的细胞群体,包括新的细胞类型、细胞状态和罕见细胞类型
组织中存在哪些细胞类型或状态(如脑组织中的神经元与星形胶质细胞)?
不同细胞类型或状态的比例如何?
相似的细胞类型或亚群(如T细胞的不同亚型)在基因表达上存在哪些差异?
表面上均质的细胞类型(如分裂与静止状态、激活与静息的免疫细胞)内基因表达程序如何变化?
是否存在罕见的细胞类型或瞬时状态在生物学中发挥关键作用?
发现新的细胞标志物和调控通路
基因在单细胞层面的共表达模式如何?
敲除某些基因如何影响特定细胞群的其他基因程序?
重建发育层次结构和谱系关系
细胞异质性如何随时间演变(比如发育或疾病进展过程)?
分析健康和病变的组织、器官和系统
单个细胞如何对治疗或疾病状态等刺激或扰动作出反应?
某些细胞或细胞类型是疾病生物学或治疗耐药的主要驱动因素吗?
整合批量细胞和单细胞分析来揭示B-ALL中的可成药靶点
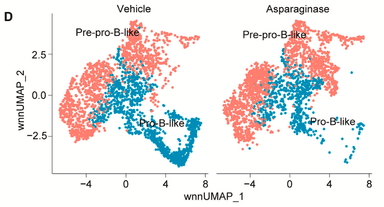
Huang等人2024年在《Cancer Cell》上发表论文,通过健康人类B细胞和白血病临床样本的批量细胞和单细胞RNA-seq分析,鉴定出驱动B细胞急性淋巴细胞白血病(B-ALL)对常见化疗药物(天冬酰胺酶)耐药或敏感的发育状态。看看他们发现了什么。
5. 批量细胞RNA-seq的优缺点
批量细胞RNA-seq工作流程的优势在于其作为全转录组分析的低成本方案,专注于群体层面的见解。对测序深度的要求较低,进一步降低了成本。此外,样本制备的要求更简单,数据复杂度和分辨率较低,这使得工作流程更轻松,分析过程也更简单易懂。
然而,这些优势是以分辨率和生物学发现潜力为代价的。批量细胞RNA-seq提供样本内所有细胞的基因表达平均读数,因此它无法解析基因表达读数的细胞来源。如果单个或少数细胞类型是某个基因或特定转录本的主要贡献者,这种现象将会被掩盖。
这也意味着批量分析的读数无法揭示样本的细胞异质性,因此对高度异质性的组织来说不大理想。相反,单细胞测序能够揭示这种异质性,甚至能将那些驱动独特基因表达谱的罕见、低丰度细胞类型呈现出来。
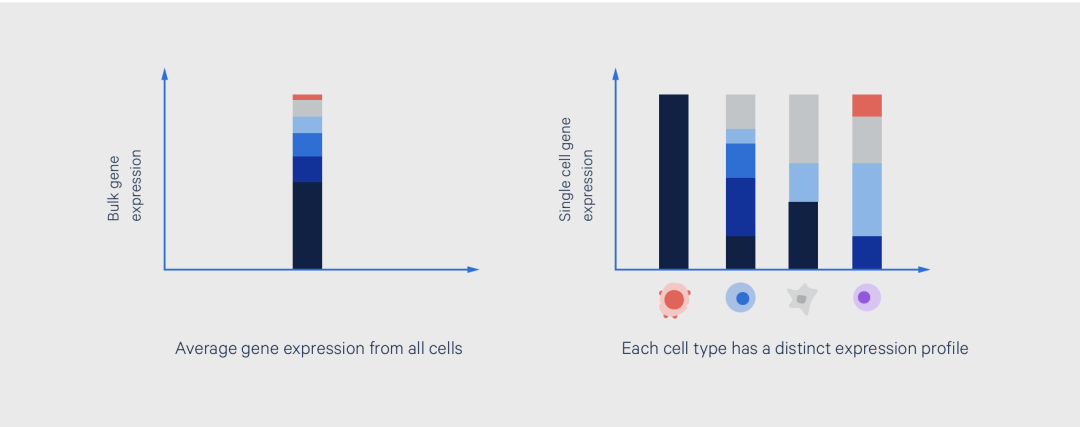
图2. 批量细胞和单细胞RNA-seq的基因表达读数的分辨率对比。左图从批量分析的视角展示了样本的转录景观,呈现6个基因的平均表达水平。右图则代表单细胞基因表达数据,揭示样本中真实的细胞异质性,以及在平均视角下观察到的表达模式的细胞来源。
6. 单细胞RNA-seq的优缺点
单细胞RNA-seq具有强大的优势,能够以单细胞分辨率开展全转录组分析,这将推动前所未有的生物学发现。10x Genomics提供的单细胞技术另具优势,采用可靠且可重复的仪器辅助流程,通过关键步骤的自动化减少失误,确保最高的数据质量。
然而,单细胞工作流程是以成本和复杂性为代价的。在价格方面,单细胞RNA-seq通常比批量分析成本更高。部分原因在于捕捉罕见特征往往需要更深度的测序,从而导致整体实验成本升高。
在复杂性方面,单细胞RNA-seq需要将样本解离为单细胞悬液并保持高细胞活力,使得样本制备流程在技术上更复杂。此外,为了充分挖掘单细胞数据集的潜力,可能还需要采用不熟悉的分析方法。
当然,困难的事情往往伴随着丰厚的回报。正如您在多项研究成果中发现的,单细胞分析为研究带来的价值,足以抵消您在尝试学习这项技术过程中可能遇到的种种阻力。
更重要的是,与单细胞RNA测序相关的诸多挑战正在不断得到解决和缓解,让这项技术比以往任何时候都更容易实现。
关于单细胞实验的障碍,您应该了解的:
 成本
成本
成本往往是新用户的主要障碍,特别是那些采用批量分析的用户。不过,批量分析中每个样本的成本低并不意味着长期节省。若缺乏高分辨率,您可能错过对推动项目进展(或在高影响力期刊上发表论文)很关键的新细胞类型或低丰度转录本。
选择10x Genomics的技术,您不仅能获得单细胞分辨率,还能获得更高的基因灵敏度、更低的错误率,以及一次就成功的自信。我们正采取一些重大举措,让Chromium单细胞技术更符合您的预算:
GEM-X Flex基因表达分析:通过支持高通量的单细胞实验,降低每个细胞的成本。此外,Flex分析通过高度灵敏的转录本检测,让您的测序预算发挥最大作用。
Chromium Xo:仪器配合通用型3’基因表达分析使用,为高性能单细胞分析提供了经济实惠的入门方案。
 实验难度
实验难度
样本制备上的新要求以及不熟悉的仪器工作流程看上去令人生畏,但实际上每个单细胞实验都遵循三个与批量实验相似的基本步骤:样本制备、运行检测和数据分析。

图3. 每个单细胞实验中的三个基本步骤。
我们提供优化的样本制备方法助力您取得成功,包括覆盖Chromium单细胞产品组合的40多种示范方案,以及详尽的解说视频和用户指南。我们的支持资源还包括全球现场应用科学家团队提供的样本制备和实验设计方面的专业指导。
此外,Chromium X系列仪器的按键式简便操作带来了卓越的可重复性,同时节省时间。我们实现了单细胞工作流程中最关键步骤的自动化,在数分钟内完成数千个细胞的微滴生成,且手动操作仅需3-4小时,最大限度减少了人工移液操作中的失误。若您暂不考虑购置仪器,也可以与提供Chromium单细胞服务的众多核心实验室合作。

图4. Chromium X仪器内的微流控通道中形成GEM的演示视频。
这种可靠的仪器辅助的微滴生成的效果不言自明:凭借高达80%的细胞回收率,您可以从每个样本中收获更多,包括低起始量细胞和脆弱细胞。由于不同运行、用户和时间点的R²值高达0.97,您还可以确保分析性能一致。
 数据分析
数据分析
我们将竭尽所能,让您无需生物信息学经验即可获取并解读单细胞数据。我们开发出免费且用户友好的软件,助力您加快得出实验结论:
Cell Ranger分析流程:处理scRNA-seq数据,快速提供结果。
通过交互式Loupe Browser软件对处理后的数据进行可视化,快速绘制您关注基因的差异表达谱。
利用持续不断的创新进一步简化数据分析,包括自动化的细胞注释(beta测试版)。
借助这些工具,您能够鉴定细胞类型和状态,检测稀有转录本,对多个样本进行比较等。您在刚开始时也并非孤军奋战。我们的分析指南(2)汇集了单细胞数据分析的介绍、教程和文章,无论您是经验丰富的专家还是分析首个数据集,都能从中获益。
7. 单细胞RNA-seq的影响及未来趋势
尽管批量细胞RNA-seq有着广泛的应用,但仍有一些是无法做到的。某些发现唯有通过单细胞技术才能实现。数千篇文献证实了单细胞RNA-seq的作用和影响,我们在此精选几例:
寻找囊性纤维化突变的细胞来源
“肺部离子细胞”的发现证明了通过单细胞测序技术确定新细胞类型如何对疾病研究产生重大影响,这种在所有肺部细胞中仅占0.5%的细胞类型却是导致囊性纤维化的CFTR突变基因的主要来源(3)。
鉴定黑色素瘤中耐受免疫检查点的细胞状态
为了寻找更持久的黑色素瘤治疗方案,研究人员采用单细胞RNA测序技术揭示了与免疫检查点抑制剂耐药性相关的恶性细胞状态(4)。
揭示COVID-19重症疾病背后的细胞程序
一项基于COVID-19重症病例尸检组织的单细胞图谱研究发现髓系细胞和上皮细胞是富含SARS-CoV-2 RNA的主要细胞类型,并指出导致肺功能衰竭的细胞机制(5)。
8. 单细胞RNA-seq入门指南
批量细胞和单细胞RNA-seq既相似又不同,并具有互补性。这两种方法都试图通过NGS读数来了解转录组,但分辨率不同:组织水平 vs.单细胞。
单细胞技术在解析生物学异质性方面具有根本性优势,而批量分析的读数则隐藏了这种异质性。从鉴定新的细胞类型和状态,到揭示疾病、治疗应答和耐药的潜在机制,单细胞测序带来的见解正在推动突破性研究,有望彻底改变生物学和医学领域。
开启单细胞RNA测序之旅
欢迎扫描下方二维码联系我们,在选择合适的单细胞分析或根据预算定制实验设计方面获得专业指导。我们将全力帮助您达成研究目标!

参考资源:
1. https://sampled.com/bulk-rna-sequencing-vs-single-cell-rna-sequencing/
2. https://www.10xgenomics.com/analysis-guides?refinementList%5Bproducts.name%5D%5B0%5D=Universal%203%27&refinementList%5Bproducts.name%5D%5B1%5D=Flex&refinementList%5Bproducts.name%5D%5B2%5D=Universal%205%27
3. Montoro D, et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature 560: 319–324 (2018). doi: 10.1038/s41586-018-0393-7
4. Jerby-Arnon L, et al. A cancer cell program promotes T cell exclusion and resistance to checkpoint blockade. Cell 175: 984–997.e24 (2018). doi: 10.1016/j.cell.2018.09.006
5. Delorey TM, et al. COVID-19 tissue atlases reveal SARS-CoV-2 pathology and cellular targets. Nature 595: 107–113 (2021). doi: 10.1038/s41586-021-03570-8