|
circRNA的定义和特征
环状RNA (circRNA)是一类新的具有调控功能的非编码RNA,具有闭合环状结构,大量存在于真核转录组中。大部分的环状RNA是由外显子序列构成,在不同的物种中具有保守性,同时存在组织及不同发育阶段的表达特异性。由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。
|
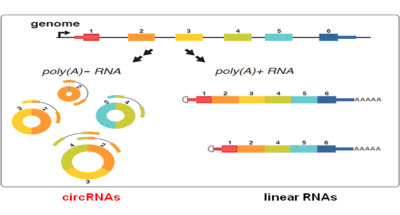
circRNA在哺乳动物细胞中的形成
|
|
circRNA特征
• circRNA没有“尾巴”
常规存在于线性RNA分子中的3’和5’端在环状RNA中被连接形成了闭合环状结构(图1)。而经典的RNA检测方法只能分离具有PolyA“尾巴”结构的RNA分子,所以环转RNA在以往的研究中通常被忽略了。
• circRNA不翻译
虽然很多circRNA是由蛋白编码基因产生,但是还没有结果显示circRNA在细胞中编码蛋白。环状RNA也因此被定义为一类新型非编码RNA。
• circRNA的细胞定位和稳定性
大部分环状RNA在细胞浆中富集,其丰度有时甚至比相应的线性mRNA高10余倍,这可能是由于环状RNA比线性RNA更稳定造成的。核酸酶往往通过识别线性RNA分子末端发挥作用,环状RNA是一个闭合结构,因此对核酸酶具有高耐受性。
|
|
国家自然科学基金为何如此“钟爱”circRNA
近年来circRNA研究如火如荼,国内研究也紧抓热点,这一点从国家自然科学基金的倾向性可见一斑:从2016年的约80项circRNA相关项目,到2017年的176项(包括2项杰出青年基金,1项优秀青年基金,2项重点项目,94项面上项目,62项青年基金项目,15项地区科学基金项目) ,再到2018年的200多项(包括87项面上项目,11项地区基金项目,65项青年基金项目等)。
其中,肿瘤学项目获批最多,如中科院生物物理所的“环形RNA CircDcun1d4调控肝癌干细胞自我更新的作用及分子机制研究”,中山大学的“环状RNA介导肿瘤相关巨噬细胞促进肺癌转移研究”等等。
|
circRNA的发展路程
|
1971年,研究者发现类病毒(Viroids)能侵染植株并导致死亡,与病毒不同的是,类病毒没有蛋白质外壳包被,基因组是单链、闭合、RNA分子。
1993年,在小鼠精子决定基因Sry中发现环状转录。
2006年,在果蝇中发现来自于Muscleblind的未知环状转录本。
2012年,Salzman通过RNA-Seq方法首次报道了~80个环状RNA。至此借助于高通量测序技术,circRNA才真正为自己正名。大量的circRNA分子被相继发现。
2013年,Nature杂志两篇重要的研究论文揭示出一些环状RNA充当分子“海绵”,结合并封闭了microRNAs。自此,环状RNA在科学界受到了前所未有的关注。

|
1979年,洛克菲勒大学的Hsu和Coca-Prados在电子显微镜下观察到的真核细胞细胞质中观测到环状RNA的存在。
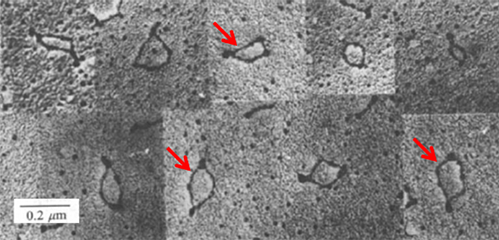
2014年,circRNA逐渐成为了RNA领域的研究热点,Arraystar公司全球首推第一款商业化circRNA芯片。
2015年,中国农业科学院植物保护研究所研究员李世访与中国科学技术大学吴清发教授合作,在世界上首次发现苹果中存在具有核酶活性的环状RNA。
2017年,德国科学家发现环状RNA与大脑功能存在关联。
2018年,越来越多的研究证实环状RNA与癌症密切相关,有望成为癌症生物标记物
|
|
“过去,人们大多把circRNA看作是奇怪的现象。随着二代测序的发展,最近四五年人们发现这些分子其实是
非常普遍的。这一全新领域在很短时间内得到了飞速发展。”
|
——希伯来大学的Sebastian Kadener |
circRNA的功能与作用
|
circRNA竞争性吸附miRNA
circRNA与相应microRNA结合,像“海绵”吸附miRNA,使miRNA无法与靶基因结合,进而共同参与调控靶基因的表达。这一作用机制被称为竞争性内源RNA(ceRNA)机制。通过与疾病关联的miRNA相互作用, circRNA在疾病中发挥着重要的调控作用,这一点是目前circRNA最主要的研究思路。
circRNAs调控可变剪切或转录过程
circRNA通过碱基互补配对直接调控其他RNA水平,circRNA可能参与蛋白翻译。一直被认为是非编码RNA的circRNA也能编码多肽,并通过其行使功能。circMbl是由剪切因子MBL的第二个外显子环化而来,竞争mRNA的线性剪切。CircMbl的侧翼外显子和自身序列包含MBL特异性结合的位点。MBL的表达水平受到circMbl的调控影响。研究表明,MBL通过调整circRNA形成和线性可变剪切之间的平衡来影响可变剪切过程。formin(Fmn)基因可以通过backsplicing形成circRNA。该circRNA包含翻译起始位点作为“mRNA trap”,形成一个非编码线性转录本而减少Fmn蛋白的表达。
|
|
circRNA调节RNA结合蛋白(RBP)
circRNA能与蛋白质结合,抑制蛋白质活性、募集蛋白质复合体的组分或调控蛋白质的活性, circRNA可能参与蛋白翻译。一直被认为是非编码RNA的circRNA也能编码多肽,并通过其行使功能。
circRNA与大脑功能
circRNA可能对大脑功能很重要。比如说,一种名为CDR1的哺乳动物circRNA在神经元中含量很高,神经元基因经常产生circRNA转录本,在衰老过程中circRNA会在果蝇大脑中累积。不过人们没能全面了解哺乳动物大脑中的circRNA。
|
|
“理解环状RNA在大脑或其他器官中的功能,将是生物学的重大进步。”
|
——斯坦福大学的分子生物学教授Julia Salzman |
circRNA的研究思路与方法
以中科院生物物理研究所的范祖森教授课题组2018年发表在国际知名学术期刊Immunity(IF=22.845)的文章为例:
(芯片实验由康成生物提供技术服务)
研究人员利用Arraystar Mouse CircRNA Array研究了小鼠骨髓细胞(BM)中分离的长期造血干细胞(LT-HSCs)和多能干细胞(MPPs)的circRNAs表达谱,筛选出一个在LT-HSCs细胞核高表达的circRNA cia-cGAS,可以与DNA敏感的cGAMP合酶cGAS相互结合并抑制其酶活性,阻碍cGAS结合基因组DNA,从而不能激活I型干扰素(IFN)的表达,维持LT-HSCs的静息状态。该研究同时也发现cia-cGAS是cGAS介导的自身免疫相关的有效抑制剂,为有效防治自身免疫性疾病与血液系统恶性肿瘤提供了新思路和潜在药物研发靶标。研究成果2018年发表在国际知名学术期刊Immunity(IF=22.845)。
|
一、研究背景
长期造血干细胞(LT-HSCs)是潜能最高的干细胞系,具有最高的更新和分化能力,可以为短期造血干细胞、多能干细胞(MPPs)等提供了持续性细胞补给。大多数时候,LT-HSCs处于休眠的静息状态,其干性的维持受多种因素的影响。
|
|
二、研究思路+技术路线
Step 1 筛选
研究人员通过Arraystar Mouse CircRNA芯片分析了小鼠骨髓中分离的长期造血干细胞LT-HSC与多能干细胞MPPs的circRNAs表达谱,筛选出156种差异表达的circRNAs。qPCR验证结果与芯片一致。
Step 2 鉴定
shRNA慢病毒转染发现,只有D430042O09Rik基因转录的circRNA cia-cGAS可以影响LT-HSCc的亚群分布。
Step 3 表达分析
随后研究人员通过qPCR、Northern blot、核质分离及原位杂交实验发现cia-cGAS在LT-HSCs的细胞核内高度表达。
Step 4 功能分析
接下来作者对cia-cGAS的相关功能进行了研究。作者通过删除下游的反向互补序列特异性敲除cia-cGAS,FACS分析表明敲除后LSK细胞明显增多,LT-HSC明显减少,并且敲除后LT-HSCs的BrdU染色阳性率明显高于对照组,表明敲除后LT-HSCs处于活跃的增殖阶段。脉冲标记也显示敲除后LT-HSCs细胞静息状态的比例显著降低。然后作者通过对敲除小鼠的mRNA表达谱分析发现I型IFN表达显著上调,qPCR和ELISA也验证了这一结果。以上实验表明cia-cGAS可以通过I型IFN信号传导调控LT-HSCs的静息状态。
Step 5 分子机制分析
最后作者对cia-cGAS发挥功能的分子机制进行了探讨。RNA pull down、RIP、免疫荧光、EMSA和FISH实验发现cia-cGAS可以和cGAS蛋白相互作用。接下来作者通过酶活测定、ChIP、HPLC、荧光素酶和质谱实验表明cia-cGAS可以阻碍cGAS与LT-HSCs自身DNA结合,从而抑制其酶活性,不能激活I型IFN的表达。然后作者用CRISPR/Cas9突变cGAS基因,qPCR、ELISA、BrdU标记等实验表明,突变后I型IFN表达被抑制,LT-HSCs细胞数量正常且更多的维持在静息状态。这些均表明了cia-cGAS作用的机制就是通过结合cGAS抑制其表达,从而不能激活I型IFN的表达,维持LT-HSC的静息状态。动物实验显示,在cia-cGAS敲除的小鼠中,poly(I:C)与HSV病毒的刺激均可导致大量I型干扰素的产生,从而诱发自身免疫性疾病,而cia-cGAS过表达则可以消除这些,表明cia-cGAS是cGAS介导的自身免疫疾病的有效抑制剂。
|
第二个例子:看曹雪涛院士如何做circRNA研究! |
曹雪涛院士课题组和第二军医大学于益艺教授课题组合作在肝脏领域顶尖杂志Hepatology(IF=13.246)发表了题为“Circular RNA MTO1 acts as the sponge of miR-9 to suppress hepatocellular carcinoma progression”的文章,研究失调的circRNA和肝癌中的功能。
(芯片实验由康成生物提供技术服务) |
一、研究背景
肝细胞癌(HCC)是一种高死亡率的原发性肝癌,是最常见的恶性肿瘤之一。一些内源性的非编码RNA如circRNA在发育、细胞功能和特定的病理学应答中发挥重要作用,使得对失调的非编码RNA在癌症生物学中的作用的研究越来越引起人们重视。
二、研究思路+技术路线
Step 1 筛选——从临床样本出发,通过高通量芯片筛选结合qPCR验证得到目标circRNA。
作者选择了7例HCC组织及其相应的正常组织对照,用高通量circRNA microArray进行分析,筛选出肝细胞癌中20个差异最为显著的CircRNA做聚类分析——其中包括10个circRNA显著上调,10个circRNA显著下调,qPCR验证了这20个circRNA与芯片结果一致。
Step 2 鉴定——鉴别并确认目标circRNA,并在更大量临床样本中确认普遍性
作者对来源于21个病人的HCC样本中对上述20个circRNAs的表达情况进行了验证,确认circMTO1 (has_circRNA_0007874/has_circRNA_104135)在HCC组织中显著下调。继续放大样本量,结果发现相对于正常肝组织,circMTO1在87.4%(228/261)的肝癌组织中表达显著下降。用过组织原位杂交(ISH)等方法表明,HCC组织中circMTO1表达越低,HCC病人的预后越差,circMTO1与HCC病人的恶性程度相关。
尽管还有几个候选circRNA(circARID1B, circFAM13B, 和circFARP2)在HCC样本中也有下调,但是沉默这些circRNAs对HCC细胞的生长没有明显的影响,而沉默circMTO1会明显促进HCC细胞的增殖。
Step 3 表达分析
用组织原位杂交(ISH)等方法分析116例带有生存数据的样本,结果表明,HCC组织中circMTO1表达越低,HCC病人的预后越差,circMTO1与HCC病人的恶性程度相关。
Step 4 功能分析
过表达或敲除实验表明circMTO1会影响肝细胞癌的增殖,体内实验也证实了这一结果。
Step 5 分子机制分析——以circRNA的ceRNA机制为基础,预测并筛选出circRNA结合的miRNA,检测其下游靶基因,对其分子机制进行深入研究
通过Miranda预测circMTO1能结合99个microRNA。为了确定到底是哪些miRNAs可以与circMTO1结合,作者用circMTO1特异性的探针对这99个miRNAs进行了RIP(RNA in vivo precipitation)筛选。作者着重分析了早前报道的20个可以在HCC中起作用的miRNAs,结果发现miR-9明显富集,从而确定circRNA可以和miR-9结合。
通过FISH实验表明,circMTO1确实可以与miR-9在胞质中共定位,表明circMTO1确实可以与miR-9在胞质中结合。且HCC样本中的共定位明显少于正常组织。
|
|
后继研究
研究人员在HCC细胞中沉默circMTO1,以研究circMTO1对HCC进展的影响以及与miR-9的相互作用。作者检测了8个细胞系中circMTO1和miR-9的表达情况,结果发现,SK-Hep1相比中circMTO1表达最低,miR-9表达最高,QGY-7701细胞中两种RNA的表达都适中, HepG2和SMMC-7721细胞中的circMTO1表达较高,而miR-9的表达较低。
因此,研究人员选择在HepG2和SMMC-7721细胞中沉默circMTO1。作者在circMTO1的接口处设计了siRNA,在HepG2和SMMC-7721细胞中转入siRNA后通过qPCR进行了检测,结果表明沉默circMTO1明显促进了细胞增殖,增强了细胞的侵袭,并且减少了凋亡。另外在HepG2和SMMC-7721细胞中过表达miR-9与沉默circMTO1效果相似。
研究人员还构建了circMTO1的过表达系统,在SK-Hep1和QGY-7701细胞中过表达circMTO1,明显促进了细胞的凋亡。
研究人员还发现,过表达和沉默circMTO1都不会影响miR-9的表达水平,这说明circMTO1是通过“海绵吸附”来抑制miR-9的功能的。
为了进一步证实circMTO1是否是通过“海绵”吸附miR-9来发挥抗肿瘤的作用的,研究人员检测了肿瘤抑制基因p21的表达情况(p21也是miR-9的靶基因),结果表明,无论是沉默circMTO1还是转入miR-9的mimics,在HCC细胞中都可以明显减少p21的mRNA和蛋白水平。过表达circMTO1则可以增加p21的mRNA和蛋白水平。这说明circMTO1可能是通过防止p21被miR-9下调来行使其抗肿瘤作用的。
接下来,研究人员实验表明,当加入miR-9的抑制剂时,p21的mRNA和蛋白水平都不再被下调了,circMTO1沉默也不再促进细胞增殖和抑制细胞凋亡了。这可以说明,加入miR-9的抑制剂可以阻断沉默circMTO1的作用。
体内实验
最后作者又建立了一个HCC的裸鼠模型(SMMC-LTNM),通过尾静脉注射circMTO1的siRNAs,两周之后发现,肿瘤生长加速了,血清中AFP的水平明显增加。尾静脉注射siRNAs48h后SMMC-LTNM的肿瘤组织中circMTO1和p21的表达水平明显减少。另外,内源性敲低circMTO1也会抑制p21及其下游CDK2的表达,而细胞侵袭和增殖的marker MMP2和PCNA则上调。这些数据表明circMTO1可以在体内抑制HCC的进展。
|
|
|
|
|
Tips——研究circRNA的思路(来源:网络)
一、筛选circRNAs。常用方法:高通量芯片筛选,RNA-seq等
二、验证与鉴定circRNA+表达分析。常用方法:Q-PCR,FISH,Northern等
circRNA的RT-PCR验证特别之处。
常规PCR引物只针对目的片段的上下游进行设计,而circRNA引物可分以下两种方式设计:
1)外显子环化circRNA,需要特异性针对剪切位点处(backsplice junction site)来设计primer;
2)内含子环化circRNA,可跨剪切位点设计,也可围绕内含子区域设计引物。另外,circRNA引物设计建议还需要满足扩增产物长度不超过100bp;且内参基因不能选用线性mRNA,可采用外参弥补。
circRNA表达的组织特异性验证:用原位杂交技术(Situ Hybridization)进行验证。设计杂交探针时要跨backsplice junction位点,而后可很清楚的看到circRNA在哪些组织中表达很高,作为组织特性判断的依据。细胞定位是决定调控机制研究方向的关键。
|
|
三、circRNA功能分析常用方法:正向验证——circRNA过表达;反向验证——circRNA沉默/敲除
正向验证——circRNA过表达
目前比较公认的成环机制为circRNA侧翼序列的碱基互补配对,称之为Alu结构。基于此,可用PCR扩增含侧翼Alu序列的目标DNA序列,而后依据相应限制性内切酶位点进行酶切,连接至pEGFP-C1载体中。将连接载体转染相应细胞样本,定量PCR检测转染效率。最后用divergent primer验证circRNA过表达倍数。
过表达策略:1.扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;2.目标区域扩增基于基因组DNA为模版。
|
反向验证——circRNA沉默
沉默circRNA,可用siRNA沉默,即针对circRNA 的backsplice junction位点前后序列设计siRNA;而对于内含子环化circRNA,还可针对内含子区域设计相应siRNA。最后利用Divergent primer验证circRNA敲除倍数。此外,每个siRNA设计相应的对照(backsplice junction位点一端互补配对,另一端错配)。 |
四、circRNA机制研究
目前针对circRNA的功能机制研究不多,潜在的调控基因表达和蛋白合成方式有:
1)circRNA可以作为“sponge”海绵吸miRNA,调节靶基因;
2) circRNA能与蛋白质/RNA结合,募集蛋白质复合体的组分或调控基因的表达;
3)circRNA通过碱基互补配对直接调控其他RNA水平。
一般来说,ceRNA调控机制是circRNA作用机制研究的首选,因而很多文章优先从ceRNA的角度去解释其作用机理。而circRNA作为miRNA的“sponge”有两个基本前提:
1)circRNA和mRNA有共同的miRNA结合位点。
2)circRNA影响其竞争结合对象mRNA的表达。
首先用RNA-FISH确认circRNA在细胞中的定位。细胞定位是决定调控机制研究方向的关键。转录后调控尤其是ceRNA调控,一般认为在细胞质中进行,如果该circRNA主要定位于细胞质,那么是有可能成为ceRNA分子的。
|
寻找靶定circRNA的miRNA及miRNA靶定的mRNA。
1)利用生物信息学对其进行预测,即通过miRcode/starBase筛选circRNA潜在的miRNA结合位点(MRE),同时通过miRTarBase预测miRNA的靶基因。而后用通过荧光素酶报告系统及免疫共沉淀(RIP)进行验证circRNA和mRNA之间的表达呈正相关性。
2)也可直接通过circRNA+mRNA组合芯片高通量筛选,分析差异表达circRNA和mRNA之间的表达相关性分析,寻找与circRNA关系密切的mRNAs |
|
最后,验证circRNA对miRNA及其下游靶基因的表达影响。这部分可通过过表达和沉默circRNA中检测mRNA的变化,过表达和沉默mRNA来检测circRNA的变化以及circRNA和mRNA表达相关性分析加以验证。
|
|
|
|
其它案例
|
这篇题为“CircNT5E acts as a sponge of microRNA-422a to promote glioblastoma tumorigenesis ”的文章,对GBM相关的非编码RNA进行了深入研究,发现 circNT5E能够作为miRNA-422a的海绵吸附体,抑制其活性,进而影响胶质母细胞瘤的肿瘤发生。
筛选分子
作者收集3对临床GBM样本,进行高通量检测,对其中差异表达的RNA进行生物信息学分析,挑选了548个表达上调的circRNA/lncRNA进行进一步的研究。通过TargetScan预测,确定38个高潜在的miRNA-442a海绵吸附体,并利用生物素标记的miRNA pulldown实验,锁定了目标circRNA—hsa_circ_0077232 (circNT5E)。
circNT5E介导的GBM表型研究
在确定目标后,就要研究一下circNT5E是不是会对GBM表型有影响,研究者使用FISH检测了正常,WHO I,WHO II,WHO III和WHO IV胶质瘤组织中的circNT5E。结果显示,随着临床分类的增加,circNT5E的表达水平显着增加(下图a-b)。
在配对的GBM肿瘤组织(n = 18)中进行的qRT-PCR测定显示肿瘤组织中circNT5E表达显着高于正常组织(下图c)。这些结果表明circNT5E在胶质瘤中起着致癌基因的作用,从而促使我们研究circNT5E的功能。而后检查细胞活力,增殖,凋亡,侵袭和迁移能力。
体内外实验表明,circNT5E不仅对GBM细胞的增殖、凋亡、迁移及侵袭有一定的影响,还能有效促进体内GBM肿瘤的形成。
circNT5E如何行使功能
确认过表型,是遇见对的circRNA~
研究者要对circNT5E在GBM中如何行使其功能进行研究。综合考虑生物素标记的miRNA pulldown实验结果,circNT5E的编码能力以及circNT5E大量稳定存在于GBM细胞质中的事实,研究者选择从ceRNA的角度来进行深入分析。
研究结果表明,circNT5E可直接结合miRNA-422a,作为其海绵吸附体影响下游靶基因的表达。
进一步实验表明,circNT5E能够通过与miRNA-422a的结合,解除miRNA-422对其下游靶基因的抑制作用,进而影响GBM细胞的增殖、凋亡、迁移及侵袭。
研究者利用高通量的方法筛选了GBM相关的非编码RNA,circNT5E可通过海绵状胶质母细胞瘤抑制因子miRNA发挥额外的调节功能。 这些结果为开发胶质母细胞瘤的新型治疗方法提供了意见。
|
|
第二例:PRMT5 Circular RNA Promotes Metastasis of Urothelial Carcinoma of the Bladder through Sponging miR-30c to Induce Epithelial–Mesenchymal Transition. Clinical Cancer Research. 2018circPRMT5通过ceRNA机制诱导上皮间质转化,促进膀胱尿路上皮癌转移
|
中山大学肿瘤防治中心附属肿瘤医院谢丹课题组利用Arraystar circRNA 芯片研究发现在circPRMT5与膀胱尿路上皮癌(UCB)的晚期病人与生存较差的病人中存在正相关。而后功能研究发现circPRMT5可以通过吸附miR-30c促进UCB细胞的上皮间质转化(EMT)。临床研究发现circPRMT5/miR-30c/SNAIL1/E-cadherin通路对于UCB增殖极其重要,而且circPRMT5在UCB临床病人的血清和外泌体中都上调表达。该研究成果发表在学术期刊Clinical Cancer Research(IF: 9.619)。
(芯片实验由康成生物提供技术服务) |
研究背景:
膀胱尿路上皮癌具有较高的发病率,是世界上最常见的恶性肿瘤之一。迄今为止,还没有针对UCB转移特效药。因此深入研究UCB的肿瘤发生及转移的分子机制,可以为UCB临床患者提供更有效的抗肿瘤治疗方式。
circRNA是一类共价闭合的环状RNA,可以通过外显子跳跃和反向连接形成环状RNA。在不同的生理条件下,环状RNA的表达具有极强的动态性。近来研究发现,circRNA可以通过吸附miRNA参与到肿瘤的发生过程,因此circRNA也是一类有前景的肿瘤诊断和治疗的分子标志物。但circRNA是如何参与肿瘤的EMT过程,其分子机制仍不为人知。
外泌体是一类从细胞释放到胞外微环境的直径在30-100nm之间的具有膜结构的盘状小囊泡,其内包裹着miRNA、mRNA和蛋白,行驶着胞间信息交流的功能。最近,已有文章证实肿瘤细胞可以释放包含着circRNA的外泌体到血清中,但其病理学功能仍未知。UCB病人的血液和尿液中外泌体的数量有明显的上升,研究UCB病人的外泌体包含的circRNA及其分子功能,具有重要的临床意义。 |
研究思路:
文章着重于研究circPRMT5在UCB临床病人中的功能和机制研究 |
Step 1 筛选+鉴别+表达分析
作者运用Arraystar circRNA芯片检测UCB的肿瘤组织和正常组织中circRNA的表达量,通过差异倍数、p值、FDR值筛选之后,发现circPRMT5的表达量在肿瘤组织中上调最明显。随后,作者收集119对UCB肿瘤组织和配对的正常膀胱组织,通过qPCR验证了circPRMT5在UCB肿瘤组织中普遍上调。 |
Step 2 功能分析+分子机制
为了研究circPRMT5在UCB组织中的功能,作者构建了覆盖circPRMT5反向剪切位点的shRNA,结果显示敲低circPRMT5之后,明显抑制UCB细胞的迁移和侵袭能力。另一方面,过表达circPRMT5可以增强UCB细胞的迁移和侵袭能力。动物模型显示,通过小鼠尾静脉注射稳定敲低circPRMT5的T24细胞系(UCB细胞系),小鼠的肺部转移灶显著减少;注射过表达circPRMT5的细胞系,肺部转移灶明显增加。
机制研究显示,通过AGO2 RIP实验,circPRMT5可以与AGO2结合,进入RISC复合物。双荧光素酶报告系统显示,circPRMT5可以作为miR-30c的吸附海绵。使用生物标记的circPRMT5探针,拉取与circPRMT5相互作用的miRNA,发现miR-30c可以被富集。FISh实验验证circPRMT5与miR-30c在细胞内可以被共定位,因此作者挑选miR-30c作为circPRMT5的靶标进行后续研究。
后续研究证实,circPRMT5促进UCB细胞迁移和EMT是通过吸附miR-30c,降低miR-30c的抑制效应的方式行使功能。而且circPRMT5通过调控miR-30c/SNAIL1/E-cadherin通路,进而促进UCB细胞的EMT过程。最后,作者收集了正常人与UCB病人的血清和尿液中的外泌体,qPCR实验显示从UCB患者的血清和尿液分离的外泌体中circPRMT5的表达量更高,miR-30c的表达趋势,与circPRMT5的表达趋势呈明显的负相关。 |
研究意义:
本研究运用Arraystar CircRNA 芯片研究膀胱尿路上皮癌(UCB)组织中circRNA的表达和功能。发现circPRMT5的表达在UCB组中显著升高,并且与UCB病人差的预后相关。功能和机制研究发现,circPRMT 5通过海绵吸附miR-30c,调控SNAIL/E-cadherin信号通路,促进UCB细胞系的EMT途径和侵袭能力,意味着circPRMT5在UCB的转移过程中起着促进作用。进一步,体内干预circPRMT5实验表明circPRMT5是一个新的原癌环状RNA分子。结果不仅仅阐释了UCB转移的新机制,也表明circPRMT5可作为UCB治疗的靶标。
|
circRNA与疾病
近来研究开始关注于circRNA可能在疾病病理方面起到的作用。例如,环状ANRIL(cANRIL)是长链非编码RNA ANRIL的环状拼接形式,其在人类细胞中的表达与该位点上几个可能影响ANRIL拼接的SNP有关,能调节INK4/ARF的水平并增加动脉粥样硬化的风险。这项研究充分证明circRNA与疾病的发生存在关联,并能很好地作为疾病新型生物标记。
此外,更多的证据显示,环状RNA在miRNA水平的微调上起着非常重要的作用,通过竞争结合miRNA来调控基因的表达。而与疾病关联miRNA的相互作用则说明环状RNA能够参与疾病调节。可以预见,有miRNA的领域,就可能有circRNA功能的研究点。通过与疾病关联的miRNA相互作用,circRNA在疾病中发挥着哪些调控作用,必将热门。再加上circRNA稳定不易降解,是否能作为生物标志物,是否可用于诊断用途,也必然是热门领域。例如,环状RNA ciRS-7在人脑组织中丰富表达,与脑特异性microRNA miR-7相互作用;而ciRS-7含有多个串联的miR-7结合位点,因此可以作为内源性的miRNA海绵,抑制miR-7活性。考虑到miR-7是各种不同癌症相关通路的重要调节因子,同时也因能直接调节a-突触核蛋白和泛素蛋白连接酶A(UBE2A)的表达而可能与帕金森和阿兹海默疾病的发生相关,所以ciRS-7也很有可能作为神经性系统疾病和癌症发生的重要调节因子。
|
案例展示:

案例一:整合分析mRNA-miRNA-circRNA测序数据揭示化学物致癌新观点
|
本研究以人类HepG2细胞为对象,利用高通量测序技术分析BaP作用过程中的致癌机制。整合mRNA、circRNA、miRNA测序数据(设置6个时间点),时序分析Bap处理对基因表达的影响。时序实验发现miR-181a-1_3p随着时间变化表达一直下调。作者以其为研究对象,寻找在BaP作用下的调控机制。靶基因预测发现,有14个差异表达mRNA(包括DNA修复基因MGMT)和16个差异表达的circRNA具有miR-181a-1_3p的作用位点。数据分析发现,随着时间的变化,miR-181a-1_3p、MGMT和cirRNA具有一定的表达相关性。作者推测:在BaP作用下,会超量表达miR-181a-1_3p,从而抑制MGMT的翻译,抑制DNA损伤修复;随着时间的增加,circRNA的表达量增加,竞争性结合miR-181a-1_3p,从而解放MGMT,一定程度上对DNA损伤进行修复。
|
|

miRNA,mRNA和circRNA之间推测的ceRNA竞争关系
|
案例二:神经环状RNA在发育期间调控突触功能
最近,研究人员采用去除核糖体的RNA进行深度测序,并结合计算工具,已从古生菌到人类等生物中发现了成千上万条新的环状RNA(circRNAs)。实验证实,一些circRNAs可以作为”海绵”吸附miRNAs,从而阻止miRNAs与其靶基因的相互作用。circRNA也可以吸附RNA结合蛋白(RBPs),进而调控细胞内相关RBPs或RNAs的运输。尽管在神经元中已鉴定到其他种类的RNA(如miRNA,lncRNA)和基于RNA的调控模式,但却少有circRNAs的研究。
研究发现,circRNAs大量富集于脑,来自于编码突触蛋白的宿主基因(图1)。高分辨率的原位杂交显示,circRNAs主要位于神经元树突(图2)。实验证实了circRNAs在发育过程中调控突触功能,许多circRNAs会在突触发生时突然地改变它们的丰度(图3)。此外,在神经活性自身稳态下降后,许多circRNAs表现出明显的上调或下调(图4)。在本研究中,未发现脑circRNAs可以结合miRNAs和RBPs,或是翻译出蛋白。
|
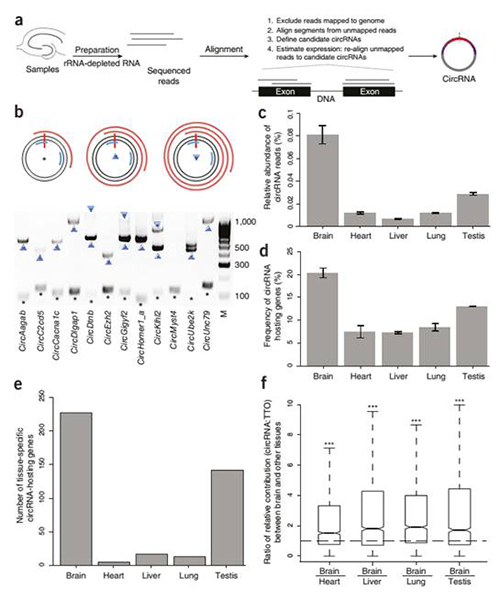
不同组织中的circRNAs表达谱,揭示circRNAs富集于脑
a. 实验与分析流程,b. circRNAs的旋转环形cDNA产物,c. 不同组织中环形测序数据占可比对基因组的测序数据的比例,d. 不同组织中产生circRNAs的基因占所有表达基因的比例,e. 不同组织中只在一种组织中表达的circRNA宿主基因的数量,f. 脑相比于其他组织,宿主基因位点上circRNAs与总转录物的丰度比例。
|
|

脑表达的circRNAs来自编码突触蛋白的基因并富集于突触组织
|
|
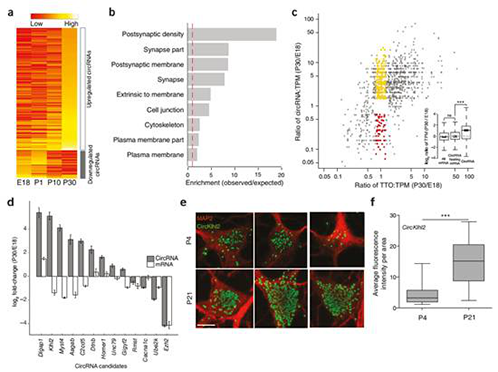
脑circRNAs在发育过程中的表达谱变化
|
|

circRNAs受到自身稳态可塑性的调控
|
|
案例三:鉴定植物中广泛存在的非编码环状RNA
本研究以水稻和拟南芥为研究对象,进行了全基因组范围circRNA的鉴定,并对其特性进行了分析。通过对水稻和拟南芥的RNA seq数据进行参考基因组比对和过滤,判断原始reads是否存在circRNA splicing,最后在水稻中鉴定到12,037个circRNA,在拟南芥中鉴定到6,012个circRNA。数据分析发现,有700个外显子circRNA的亲本基因在水稻和拟南芥中为直系同源基因,表明植物中的circRNA具有较强的保守性。植物circRNA表现出不同的表达模式,27个外显子circRNAs在磷酸盐胁迫下出现差异表达。同时发现,一些circRNA与亲本基因的表达谱表现出显著正相关。
|
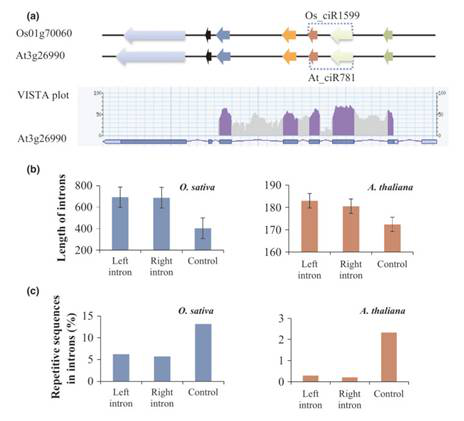
植物环状RNA特征
|
|
|
circRNA的高通量筛选及验证
|
Arraystar circRNA芯片
最新版本人V2.0、小鼠V2.0、大鼠V2.0。从circRNA研究领域顶尖期刊和权威公共数据库中收录最可靠的circRNA。剪切位点特异性探针与RnaseR预处理双重保障,特异性检测circRNA。结果注释详细,提供circRNA可能结合的miRNA以及对应host gene及线性RNA,便于从不同角度研究circRNA机制。
|
|
circRNA qRT-PCR
康成生物采用随机引物进行反转录,针对circRNA特异的back splicing site两侧序列进行引物(divergent primer)设计,该引物不受相应线性RNA分子的影响,只会对目标circRNA进行特异性扩增,实现对circRNA的表达的髙效、灵敏、准确及特异性地检测。
|
| 一站式服务了解一下 >> |
|
环状RNA的功能验证方法
|
circRNA定量验证
circRNA定量验证手段与常规PCR手段不同,常规手段是围绕目的片段的上下游分别设计PCR引物,称之为convergent primer,需扩增的片段位于上下游引物之间(如图1.1)。而对于circRNA,尤其外显子环化circRNA,除backsplice junction位点处不同于linear RNA之外,body区与linearRNA是一致的。因此,验证时需要特异性针对backsplice junction位点处设计primer,称之为divergent primer(如图),而且设计的PCR product的长度越短越好,可以增强backsplice junction位点处扩增效率。
|
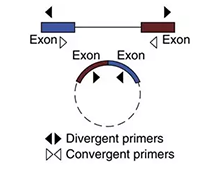
图1 convergent primer vs divergent primer
|
|
为增强circRNA的验证效率,起始模版需满足以下要求(3 free):1. DNA free;2. rRNA free;3. linearRNA free。
验证策略:对3free RNA以及genome DNA同时进行PCR扩增,电泳检测PCR product大小(如图)。
|

图2 circRNA引物扩增结果
|
|
circRNA定位
位置决定功能。位于细胞核中的circRNA可能主要调控亲本基因的转录,而位于细胞质中的circRNA可能主要发挥竞争性内源RNA—ceRNA的作用。用FISH(fluorescence in situ hybridization)荧光原位杂交技术来进行定位分析,可观察到circRNA在哪些组织中表达,作为组织特性判断的依据。探针设计时需跨越backsplice junction位点区域。
|
|
circRNA Northern blot验证
Northern blot方法是一种比较古老但行之有效的序列验证方法,需围绕circRNA设计探针序列,而探针序列设计是验证成功至关重要的环节。对于circRNA探针设计,我们建议以下两点:1. 对于外显子环化circRNA,建议探针尽可能跨backsplice junction位点;2.对内含子环化circRNA,可围绕内含子区域设计探针。
验证策略:对3 free RNA、total RNA以及genome DNA同时进行杂交验证。
|
|
circRNA过表达
circRNA过表达思想主要源于circRNA生物形成机制,已有多篇文章报道circRNA成环机制,目前比较公认的成环机制为circRNA侧翼序列的碱基互补配对,称之为Alu结构(如图)。
|
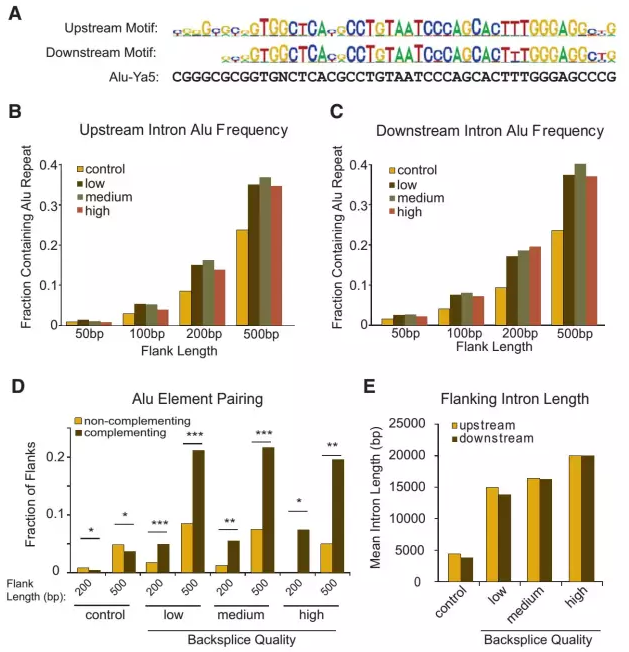
图3 circRNA侧翼结构特征
基于circRNA侧翼Alu序列特征,PCR扩增含侧翼Alu序列的目标DNA序列,随后依据对应限制性内切酶位点进行酶切,进而连接pEGFP-C1载体。连接载体进而转染对应细胞样本,定量PCR检测转染效率。基于divergent primer验证circRNA过表达倍数。
过表达策略:
1. 扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;
2. 目标区域扩增基于基因组DNA为模版。
circRNA敲除
circRNA敲除思路主要针对circRNA backsplice junction处序列信息设计siRNA,对于内含子环化circRNA,也可针对内含子区域设计相应siRNA进行干扰。Divergent primer验证circRNA敲除倍数。
敲除策略:
1、外显子环化circRNA,针对backsplice junction位点前后序列设计siRNA,如图所示;
2、内含子环化circRNA,除针对backsplice junction位点前后序列设计siRNA序列以外,也可针对内含子区域序列设计siRNA。
3、每个siRNA设计对应的对照,backsplice junction位点一端互补配对,另一端错配,如图3所示。
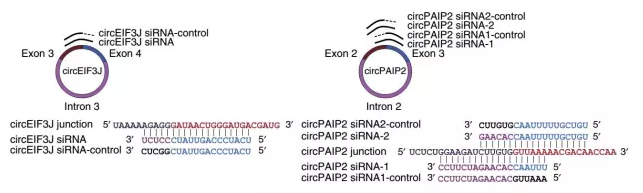
图4基于siRNA敲除策略
circRNA数据库
circbase
在circBase(http://www.circbase.org/cgi-bin/listsearch.cgi)中,我们可以通过circRNA名称(hsa_circ_0010153),转录本名称(NM_133494),染色体定位(chr1:12359258-12382803)检索circRNA的信息(序列,定位,gene_symbol等信息),你也可以直接检索mRNA相关(TP53)或是生物学过程相关(apoptosis)的circRNA。
circBase有blat功能可以进行序列比对,用于了解基因的物种保守性,不过物种较少

推荐使用UCSC(http://genome.ucsc.edu/)的blat功能
其实circBase的序列信息还是源于UCSC
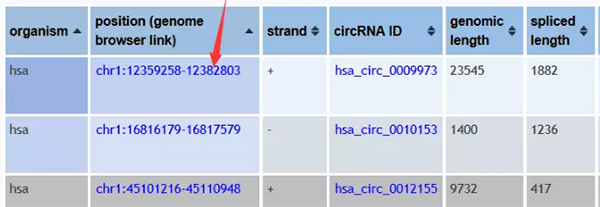
但是在UCSC中直接用hsa_circ_0010153直接搜,还偏偏搜不出下面这样的结果
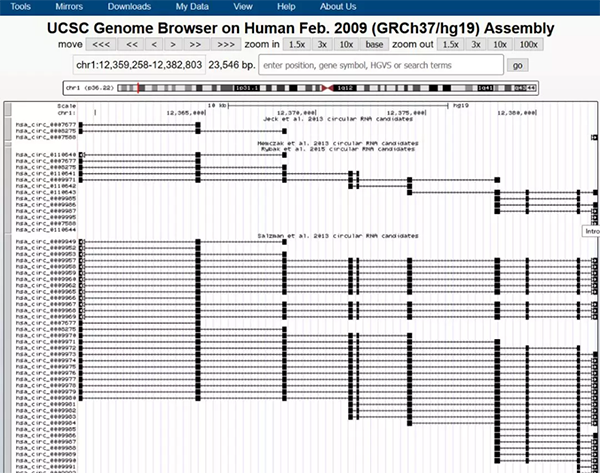
点开一条序列,即可获取该条序列的信息
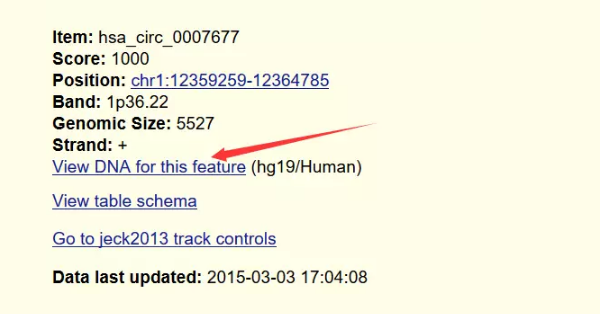
前面在circBase中,我们已经获取了circRNA的位置信息了,所以就不需要再一个个点开查看基因序列了,直接在UCSC中输入位置信息即可获得完整的基因序列。

RegRNA2.0
那我们获取了基因序列可以干嘛呢?第一反应当然是预测miRNA咯~
在RegRNA 2.0(http://regrna2.mbc.nctu.edu.tw/)中,我们可以用基因序列做很多事情,当然也包括预测miRNA。
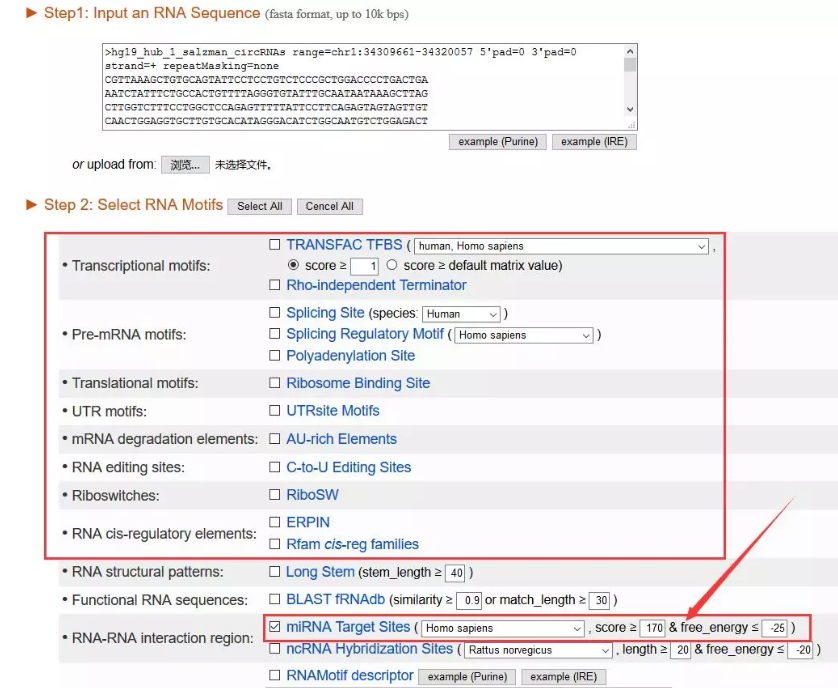
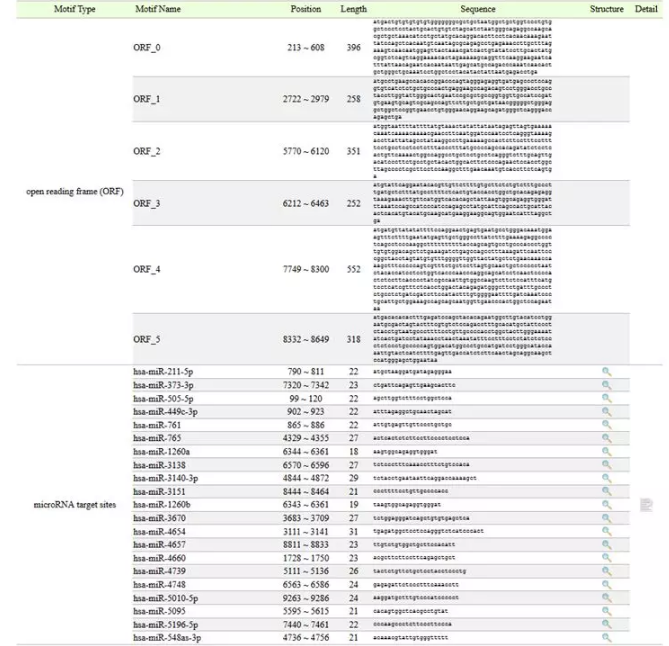
miRNA预测结果如下

circlnteractome
嫌上面这个预测circRNA的miRNA太麻烦?那你可以试试CircInteractome(https://circinteractome.nia.nih.gov/)
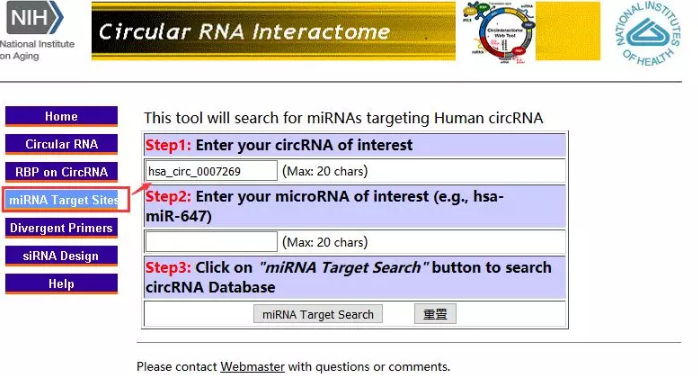
就是这么简单粗暴
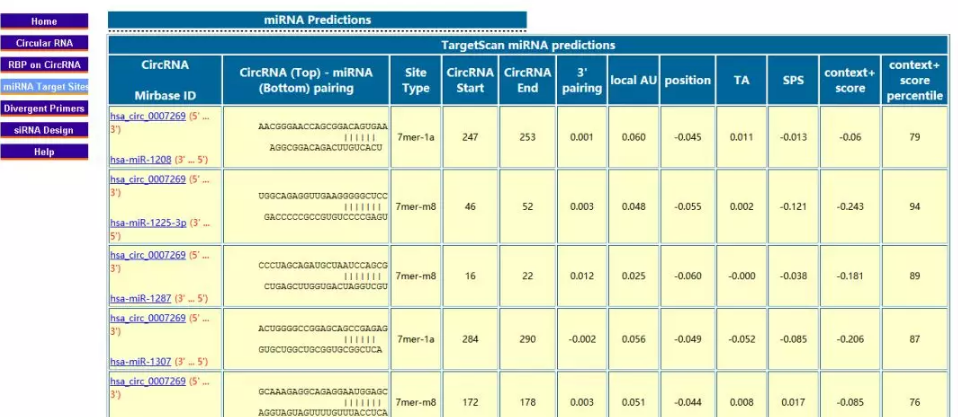
以上的检索结果如果都不能让你满意,你可以试试曲线救国的方式,用circRNA的gene sybmol来搜索相关的miRNA,比如hsa_circ_0009973的gens symbol是VPS13D。不过这样一来你得确认circRNA与miRNA结合区域在mRNA和circRNA序列中都是存在的,如果结合区域由于剪切方式不同在circRNA中被剪没了那就玩不起来了。此外由于circRNA是环状的,所以在和miRNA结合时,自由能等等参数肯定会由于分子构象发生改变,所以预测的准确性也会打折扣。
|
热门文章:
|
环状RNA的检测芯片
Arraystar circRNA芯片采用了针对特异性剪接点的探针。 线型RNA经过不同的方式拼接:外显子A 的5’端和外显子B的3’端连接,形成环状RNA。Arraystar以circRNA特异性拼接位点作为靶标序列,设计芯片探针,即使在相应的线性RNA存在的情况下也可以准确的检测circRNA。
|
|
环状RNA功能研究又一利器--过表达载体
吉赛生物利用专利技术,成功研发出特异性准确过表达 circRNAs 的表达载体,率先为研究者提供简便高效的 circRNAs 过表达研究策略。现已推出 pCD-ciR、pLO-ciR 和 PLCDH-ciR 三种 circRNAs 表达载体,适用于普通真核表达,慢病毒包装,绿色荧光和嘌呤霉素筛选等多种用途。
|
|
升级版环形RNA数据库
升级版的环形RNA数据库CIRCpeida v2共收录了6个物种(包含人、小鼠、大鼠、斑马鱼、果蝇和线虫)中超过180个样品的环形RNA计算分析结果。主要通过CIRCexplorer2和 MapSplice计算流程统计获得了262,782个环形RNA分子,其中包括73,972个可变反向剪接事件。
|
|
使用者可通过检索和下载模块获取环形RNA基因组坐标、表达水平、可变反向剪接、人鼠保守性等多样化信息,通过浏览模块在基因组上图形化查看环形RNA具体表达模式,并通过新的在线分析工具对不同样品中的环形RNA开展比较分析。
|
|
|